Il Metodo Di Bella (MDB) ha migliorato sopravvivenza, la risposta obiettiva e il performance status in uno studio clinico osservazionale retrospettivo su 55 casi di linfomi – The Di Bella Method (MDB) improved survival, objective response and performance status in a retrospective observational clinical study on 55 cases of lymphomas.
Codice: MDB002
Autore: Di Bella et al.
Data: 2012
Rivista: Neuro Endocrinology Letters, 33(8):773-781
Argomento: dati clinici Metodo Di Bella
Accesso libero: si
DOI: PMID: 23391973
BLOG: https://www.metododibellaevidenzescientifiche.com/?p=2347
Parole chiave: linfoma; somatostatina/octreotide; melatonina; retinoidi; vitamine E, D3, C; Metodo Di Bella (MDB); bromocriptina; Cabergolina
Tumore: linfoma
Traduzione: totale e fedele
Punti di interesse
I linfomi maligni rappresentano il quinto tipo di tumore più frequente nel mondo occidentale. La sopravvivenza relativa dei pazienti con linfoma di Hodgkin (HL) a 1, 3 e 5 anni è, rispettivamente, del 93%, 87% e 84% a 5 anni. Per quanto riguarda i linfomi non Hodgkin (NHL), le rispettive percentuali di sopravvivenza relativa sono dell’80% a 1 anno, del 73% a 3 anni e del 71% a 5 anni.
Attualmente sono disponibili vari tipi di trattamento prevedono l’uso di agenti alchilanti (polichemioterapia), corticosteroidi e analoghi delle purine, mentre altri sono ancora in fase di studio clinico (es. anticorpi monoclonali). Con questi trattamenti sono frequenti le recidive, la tossicità grave, come la mielosoppressione, e il rischio di infezione, con l’inevitabile coinvolgimento delle cellule staminali a seguito di trapianti autologhi e il successivo utilizzo di antibiotici, antivirali e trattamenti antimicotici.
Lo scopo di questo studio era di indagare l’efficacia e la sicurezza del MDB attraverso la combinazione di Somatostatina, Bromocriptina, Retinoidi, Melatonina, ACTH e basse dosi di Ciclofosfamina su 55 pazienti affetti da linfoma.
I pazienti ritenuti idonei all’arruolamento sono stati suddivisi nei seguenti gruppi:
Gruppo A (19 casi, 35%): pazienti sottoposti al trattamento MDB come terapia di prima linea;
Gruppo B (36 casi, 65%) : pazienti in progressione che hanno iniziato la MDB dopo chirurgia, chemio e/o radioterapia (trattamenti precedenti + MDB).
I dati hanno consentito le seguenti osservazioni:
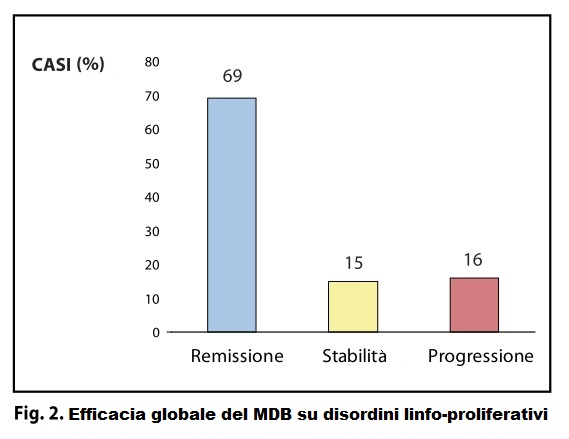
1) Sul totale dei pazienti: 84% hanno avuto una risposta completa (CR – 38 casi) o stabilità di malattia (SD – 8 casi). La progressione si è avuta nel 16% dei casi.
2) Per i pazienti affetti da Hodgkin linfoma la sopravvivenza globale a 1, 3 e 5 anni è stata rispettivamente del 92%, 82% e 82%.
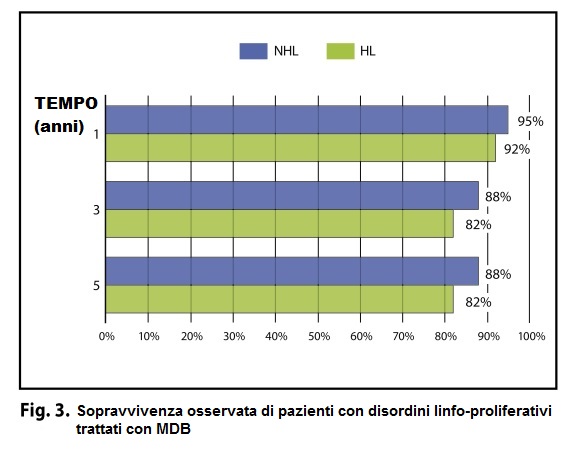
3) Nei pazienti con linfoma non Hodgkin la sopravvivenza globale a 1,3 e 5 anni è stata rispettivamente del 95%, 88% e 88% (Fig. 3).
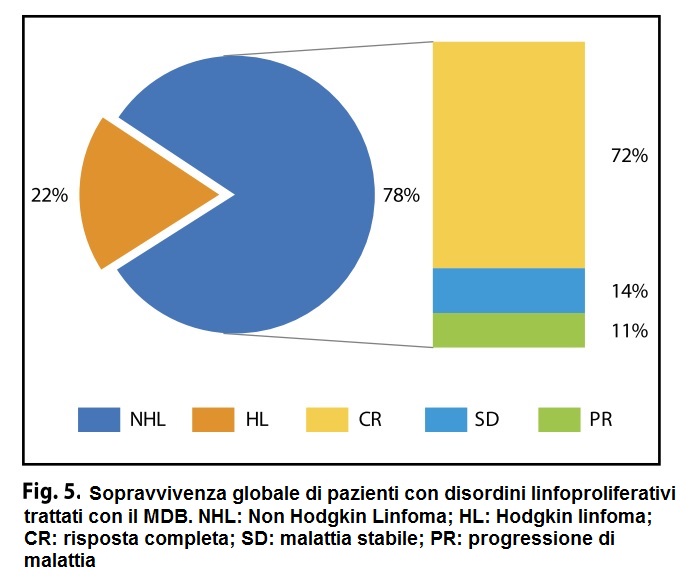
4) Sempre nei pazienti con linfoma non Hodgkin, una risposta completa è stata ottenuta nel 72% dei casi e stabilità di malattia nel 14%. Nel 11% dei casi c’è stata progressione di malattia (Figura 4).
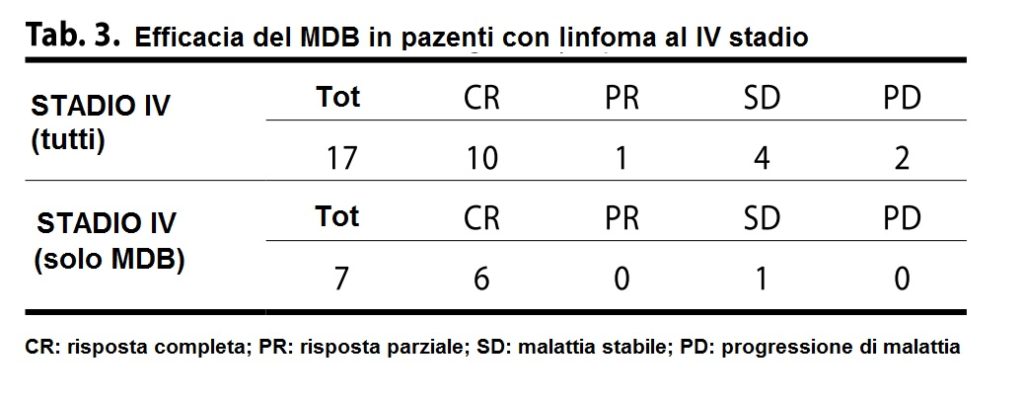
3) Dei 17 pazienti con stadio avanzato della malattia (stadio IV), 15 hanno ottenuto una risposta completa, parziale o stabilità di malattia. Due pazienti hanno riportato progressione di malattia. Sette di questi pazienti hanno ricevuto il trattamento come terapia di prima linea, e di questi 6 hanno avuto una risposta completa (Tabella 3). In nessuno dei pazienti trattato con MDB in prima linea c’è stata progressione di malattia.
Il potente ruolo mitogeno del GH e della prolattina, la loro coespressione e interattività sono noti e la progressione delle cellule neoplastiche è direttamente proporzionale all’espressione recettoriale del GH stesso. La crescita tumorale è strettamente dipendente da questi due ormoni e da tutti quei fattori di crescita (molecole mitogeniche) dipendenti dal GH e da esso positivamente regolate.
L’uso della somatostatina e dei suoi analoghi è quindi un’indicazione razionale in tutti i tumori, anche per la ormai documentata espressione recettoriale per la somatostatina in molti tumori, non solo quelli neuroendocrini. È ampiamente e da tempo dimostrato che la progressione neoplastica sia strettamente dipendente dall’angiogenesi e che la somatostatina e i suoi analoghi regolano negativamente gli “induttori angiogenici” e tutti gli stadi dell’angiogenesi. Melatonina, Retinoidi, Vitamina D 3, Vitamina C, inibitori della prolattina rafforzano quest’azione antiangiogenica della somatostatina.
Tutte queste evidenze scientifiche sono alla base dell’uso combinato di questi principi attivi in pazienti affetti da diverse forme di linfoma. L’obiettivo è quello di simultaneamente rafforzare l’inibizione di ormoni e fattori di crescita (attività antimetastatica) e ripristinare la crescita cellulare fisiologica, con la somministrazione di molecole ad azione antiossidante, prodifferenziante (riconversione del tumore o delle cellule indifferenziate alla normalità), proapoptotica (che induce la cellula tumorale alla morte cellulare, con meccanismi fisiologici, non citotossici), immunostimolante (esercitata da Melatonina e Vitamine) e antiproliferativa ( Melatonina, Somatostatina, Inibitori della prolattina, Vitamine).
Traduzione articolo
Riassunto
OBIETTIVI: I linfomi sono la forma principale di neoplasie ematologiche, rappresentando il 55,6% di tutti i tumori del sangue. Complessivamente rappresentano il 5,3% di tutti i tumori maligni (esclusi i tumori cutanei basocellulari e squamocellulari) in Italia con una prevalenza in costante aumento ad un tasso del 3% annuo. Dal punto di vista istologico rappresentano un vasto gruppo eterogeneo di malattie ematologiche, la cui stadiazione si basa su criteri citomorfologici e anatomopatologici definiti. Sebbene l’uso combinato di approcci standard possa fornire buoni tassi di risposta, la recidiva è particolarmente frequente nei pazienti sottoposti a trattamento tradizionale, con effetti collaterali critici e spesso irreversibili come la mielosoppressione e un’elevata frequenza di infezioni opportunistiche e sterilità. Numerosi studi epidemiologici e dati preclinici riportano da tempo gli effetti antitumorali di molecole come Melatonina, Retinoidi, Vitamine E, D3 e C, Somatostatina e inibitori della prolattina nelle malattie neoplastiche. Ci sono, tuttavia, pochissime pubblicazioni sugli effetti combinati di queste sostanze in vivo. METODI: Riportiamo uno studio osservazionale condotto su 55 pazienti affetti da varie forme di linfoma, trattati con la terapia biologica nota come Metodo Di Bella (MDB). Vengono riportati i tassi di sopravvivenza a 1, 3 e 5 anni, insieme a eventuali segni di tossicità. RISULTATI: Il trattamento MDB ha ottenuto risposte obiettive parziali o complete in un tempo più breve e in percentuali maggiori se somministrato come terapia di prima linea. Il trattamento adiuvante ha aumentato il tempo di sopravvivenza e migliorato la qualità della vita rispetto ai dati riportati in letteratura per gli stessi tipi e stadi di linfoma. CONCLUSIONE: Nel complesso, il trattamento è stato ben tollerato, con effetti collaterali minori e transitori. I pazienti hanno potuto continuare la cura a casa, svolgendo senza problemi le normali attività.
Introduzione
I linfomi maligni rappresentano il quinto tipo di tumore più frequente nel mondo occidentale, con un’incidenza di circa 20 casi ogni 100.000 abitanti. La sopravvivenza relativa dei pazienti con linfoma di Hodgkin (HL) è, rispettivamente, del 93% a 1 anno, dell’87% a 3 anni e dell’84% a 5 anni (Morton et al. 2006).
Per quanto riguarda i linfomi non Hodgkin (NHL), le rispettive percentuali sono dell’80% a 1 anno, del 73% a 3 anni e del 71% a 5 anni, con leggere variazioni a seconda del sottotipo (Registro Italiano dei Tumori). In Italia le stime indicano 70.130 nuovi casi nel solo 2012, con 18.940 decessi (Luminari et al. 2007). Attualmente sono disponibili vari tipi di trattamento per i linfomi, il cui obiettivo è essenzialmente la remissione il più a lungo possibile. Alcuni trattamenti sono definiti standard e prevedono l’uso di agenti alchilanti (polichemioterapia), corticosteroidi e analoghi delle purine, mentre altri sono ancora in fase di studio clinico (es. anticorpi monoclonali). Sebbene la combinazione di queste molecole possa portare anche a una risposta a lungo termine, sono frequenti le recidive, la tossicità grave, come la mielosoppressione, e il rischio di infezione, con l’inevitabile coinvolgimento delle cellule staminali a seguito di trapianti autologhi e il successivo utilizzo di antibiotici, antivirali e trattamenti antimicotici. Queste condizioni sono estremamente invalidanti, con un effetto negativo sulla qualità della vita e sulla percentuale di remissione (Danilenko & Shakhmarina 2012; Gafter-Gvili et al. 2012; Schmitz et al. 2012; Zyrina, 2012; Farha et al. 2011; Atra et al. al. 1998).
Lo scopo di questo studio era di indagare l’efficacia e la sicurezza del MDB attraverso la combinazione di Somatostatina, Bromocriptina, Retinoidi, Melatonina, ACTH e basse dosi di Ciclofosfamina su 55 pazienti affetti da linfoma.
ISCRIZIONE DEL PAZIENTE E METODI DI ANALISI
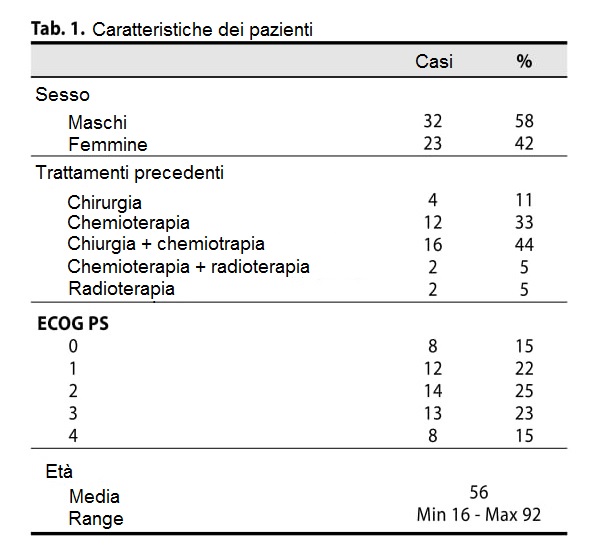
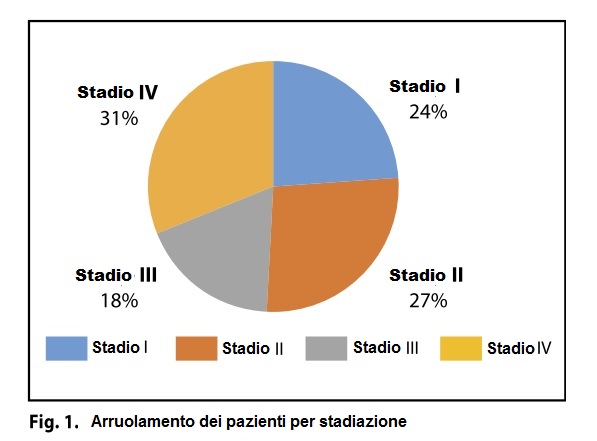
Sono stati arruolati nello studio un totale di 55 pazienti affetti da disordini linfoproliferativi. Trentasei (47%) di questi presentavano forme ricorrenti e/o refrattive di linfoma. Trentadue pazienti (58%) erano maschi e ventitré femmine (42%). L’età media dei pazienti era di 57 anni (min 19; max 95). Dodici pazienti (22%) erano affetti da linfoma di Hodgkin e 43 (78%) da linfoma non Hodgkin (Tabella 1). La stadiazione al momento dell’iscrizione era la seguente: stadio I – 13 casi (24%), stadio II – 15 casi (27%), stadio III – 10 casi (18%), stadio IV – 17 casi (31%) ( Figura 1).
Le forme più rappresentative dei casi di NHL erano il sottotipo follicolare (13 casi = 30%), mentre 15 casi (35%) erano linfoma diffuso a grandi cellule B (DLBCL) e 5 casi (12%) di linfoma di Burkitt. I pazienti con linfomi di Hodgkin includevano 8 casi (25%) della classica forma scleronodulare. La localizzazione delle lesioni era la seguente: estremità superiori (15,53%), estremità inferiori (8,62%), testa e collo (17,24%), toracica (17,24%), retroperitoneale (6,8%), uterina (3,44%), addominale ( 20,7%) e regione pelvica (10,34%).
I principali criteri di inclusione erano una diagnosi istologica o citologica di malattia neoplastica, la presenza di malattia misurabile e/o valutabile, l’interruzione del trattamento antiblastico almeno quattro settimane prima dell’inizio del trattamento con MDB e non aver ricevuto in precedenza un trattamento con MDB.
Inoltre, sono stati applicati i seguenti criteri di esclusione: pazienti che non hanno fornito il consenso informato scritto; pazienti che non hanno avuto conferma istocitologica di una specifica malattia neoplastica; pazienti che avevano iniziato il trattamento sperimentale prima dell’arruolamento; pazienti sottoposti alla valutazione basale dopo l’inizio del trattamento; pazienti che non hanno iniziato il trattamento sperimentale dopo l’arruolamento.
Queste categorie di esclusione sono state monitorate al solo scopo di valutare la tossicità del trattamento.
Sono stati invece inclusi i pazienti in progressione o deceduti prima della valutazione finale.
I pazienti ritenuti idonei all’arruolamento sono stati suddivisi nei seguenti gruppi:
Gruppo A (19 casi, 35%): pazienti sottoposti al trattamento MDB come terapia di prima linea;
Gruppo B (36 casi, 65%) : pazienti in progressione che hanno iniziato la MDB dopo chirurgia, chemio e/o radioterapia (trattamenti precedenti + MDB).
I pazienti del gruppo B sono stati suddivisi nei seguenti sottogruppi: B1: 12 casi (33%), solo chemioterapia; B2: 4 casi (11%), solo chirurgia; B3: 2 casi (5%), chemioterapia + radioterapia, B4: 16 casi (44%) chirurgia + chemioterapia; B5: 2 casi (5%) solo radioterapia.
Raccolta dati
Per ogni paziente arruolato nello studio è stata predisposta una specifica scheda contenente le informazioni cliniche. Questi moduli includevano le seguenti sezioni:
Prima sezione: valutazione basale al momento dell’arruolamento del paziente. In questa sezione sono indicati lo stadio della malattia, le sedi delle lesioni (stadiazione), i parametri ematologici e gli specifici produttori di tumore;
Seconda sezione: valutazione periodica; in merito alla rivalutazione delle sedi delle lesioni e dei parametri ematologici (re-staging), unitamente alle informazioni su eventuali effetti collaterali indesiderati del trattamento;
Terza sezione: condizioni cliniche del paziente fino al termine dello studio (follow-up).
Protocollo terapeutico
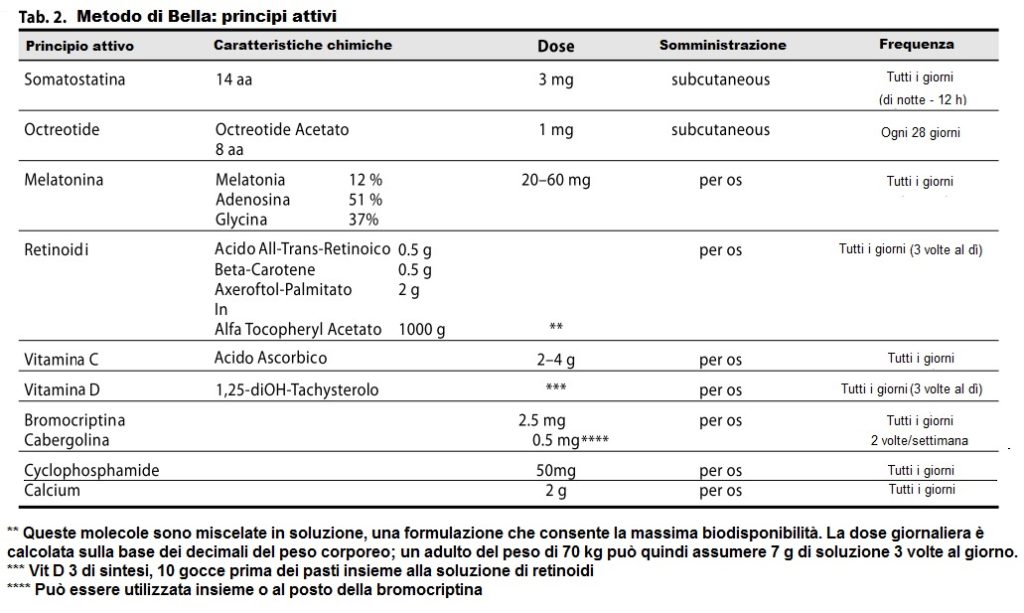
Tutti i pazienti hanno ricevuto una combinazione giornaliera di somatostatina più retinoidi, melatonina, vitamina C, Vit. D, Bromocriptina e basse dosi di Ciclofosfamide. Le rispettive dosi e modalità di somministrazione sono indicate di seguito (Tabella 2).
Valutazione dell’attività antitumorale
Questo parametro è espresso in proporzione alle risposte obiettive parziali e complete, definite secondo le linee guida dell’Organizzazione Mondiale della Sanità (OMS) (Therasse et al. 1999). La valutazione clinica è stata effettuata durante i periodi di ri-stadiazione della malattia.
Sulla base dei criteri adottati per la valutazione della risposta in caso di risposta completa e/o parziale, si è resa necessaria la conferma definitiva dopo 4 mesi di trattamento MDB.
Per valutare l’attività antitumorale del trattamento, tutti i pazienti sono stati classificati durante il periodo di rivalutazione sulla base dei seguenti esiti: risposta completa/parziale dopo 4 mesi, progressione della malattia, stabilità, morte, sospensione volontaria, interruzione per possibile tossicità.
Uno studio di follow-up è stato condotto per l’analisi di sopravvivenza. Per valutare i dati clinici sono state utilizzate la sopravvivenza globale (OS) e la sopravvivenza a 1, 3 e 5 anni.
È stata inoltre tracciata una curva di sopravvivenza (intent-to-treat, ITT) dal momento dell’arruolamento fino alla fine dello studio (60 mesi). Da questa curva sono state quindi calcolate la sopravvivenza libera da progressione (PFS) e la sopravvivenza globale (OS).
Valutazione della tossicità
Tutti gli effetti indesiderati sono stati valutati in base al grado di correlazione con il trattamento, secondo criteri standard (plausibilità dell’intervallo di tempo tra la somministrazione del farmaco e la comparsa degli effetti collaterali; presenza di eventuali cause alternative, ben noti effetti collaterali correlati a una o più sostanze, diminuzione e/o scomparsa dell’effetto collaterale per riduzione/sospensione della sostanza; ricomparsa dell’effetto collaterale a seguito della risomministrazione del farmaco; e sulla base delle osservazioni degli operatori sanitari.
Sono stati presi in considerazione solo gli effetti collaterali che, per quanto riguarda la tossicità, potevano essere correlati al trattamento sperimentale (grado di correlazione: possibile, probabile, certo) (Oken et al. 1982).
RISULTATI
Interpretazione statistica dei dati
Un’indagine clinica (studio pilota) è stata condotta su 55 pazienti affetti da linfoma, prevalentemente recidivante o refrattario, per un periodo di 5 anni. I dati raccolti sono stati sottoposti a valutazione statistica ed è stata tracciata una curva di sopravvivenza intent to treat (ITT), che mostra il tempo di inizio del trattamento sull’ascissa e la percentuale di sopravvivenza sull’ordinata (vedi grafico). L’endpoint primario era il tasso di risposta obiettiva (ORR) valutato da una revisione indipendente. Gli endpoint secondari erano il tasso di remissione completa (CRR), la durata della risposta, la sopravvivenza libera da progressione (PFS), la sopravvivenza globale (OS) e la sicurezza e tollerabilità. Al momento dell’analisi di follow-up a lungo termine, i dati hanno consentito le seguenti osservazioni:
1) Una risposta completa (CR) e una malattia stabile (SD) è stata osservata in 38 + 8 casi (84%). Nove casi (16%) erano in progressione (P) (Figura 2).
2) Per i pazienti affetti da LH, la sopravvivenza globale a 1, 3 e 5 anni è stata rispettivamente del 92%, 82% e 82%, mentre per quelli con LNH è stata rispettivamente del 95%, 88% e 88% (Fig. 3). Sempre nei pazienti con LNH una risposta completa è stata ottenuta nel 72% dei casi e stabilità nel 14%; L’11% dei casi era in progressione (Figura 5).
3) Dei 17 pazienti con stadio avanzato della malattia (stadio IV), tutti i 17 hanno ottenuto una risposta completa e stanno proseguendo il trattamento. Sette di questi pazienti hanno ricevuto il trattamento come terapia di prima linea (Tabella 3).
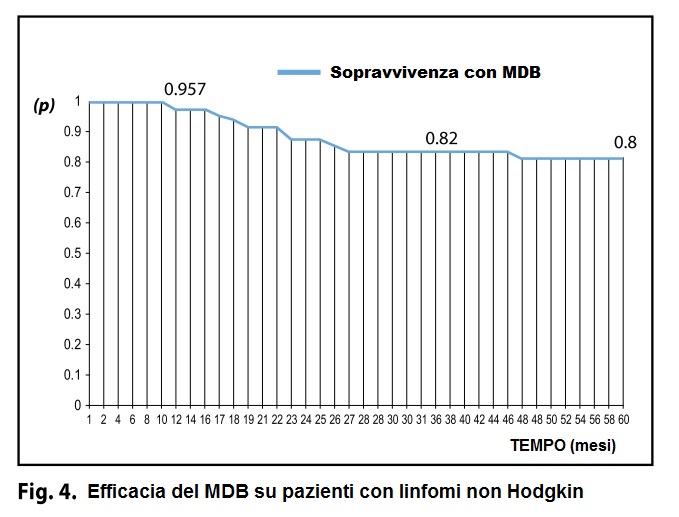
La curva di sopravvivenza (Intent To Treat) (Figura 4) mostra che:
(a) dopo 12 mesi di trattamento, circa il 96% dei pazienti era ancora vivo;
(b) dopo 36 mesi di trattamento, circa l’82% era ancora vivo;
(c) alla fine dello studio (60 mesi), la sopravvivenza globale (OS) era di circa 80%
(d) l’andamento della curva evidenzia un numero significativo di decessi nei primi tre anni dopo il trattamento
Nessuna recidiva della malattia è stata osservata nei pazienti che hanno ricevuto il MDB come terapia adiuvante.
Performance status
Un notevole miglioramento è stato osservato nella sintomatologia generale, particolarmente evidente nei pazienti che non avevano ricevuto un trattamento precedente (chemio, radioterapia, corticosteroidi). Ciò ha consentito di continuare il trattamento a casa, svolgendo senza problemi le normali attività.
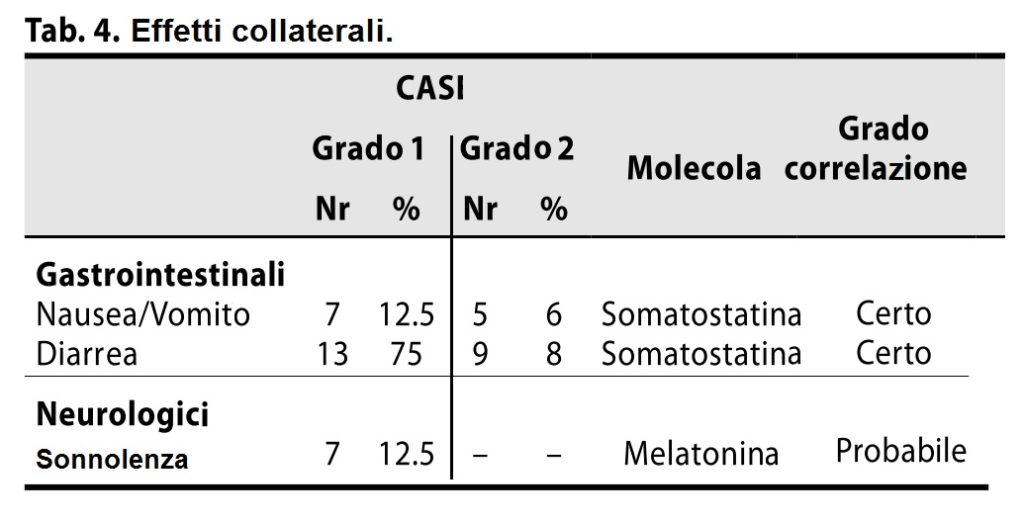
Effetti collaterali
Gli effetti collaterali dovuti al trattamento sono stati lievi e transitori (gradi 1–2) (Tabella 4). La maggior parte erano sintomi generali, quali disturbi gastrointestinali (diarrea, nausea) e lieve sonnolenza, probabilmente dovuti rispettivamente alla somministrazione di somatostatina e melatonina. Tali effetti si sono rivelati transitori, con aggiustamento della dose e successiva scomparsa dopo circa 6 mesi (min 4, max 12).
Non ci sono stati decessi correlati al trattamento farmacologico (Tabella 4).
DISCUSSIONE
Molecole come la somatostatina (SST), la prolattina (PRL), i retinoidi e la melatonina (MLT) sono in grado di influenzare la crescita linfoide (Sharma & Vinayak 2013; Sharma & Vinayak 2012; Paternoster et al. 2009; Bao et al. 2006; Bruemmer et al. 2003; Ashfaq et al. 2000; Brown et al. 1997; O’Neal et al. 1991; Persengiev & Kyurkchiev 1993; Abb & Deinhardt 1981), mentre l’uso della ciclofosfamide nei disordini linfoproliferativi è ben noto in campo ematologico.
L’espressione recettoriale ubiquitaria del PRL e dell’ormone della crescita (GH) rappresenta uno degli aspetti diretti e generalizzati del ruolo mitogeno di queste molecole. Sono noti e ampiamente documentati il potente ruolo mitogeno del GH e della prolattina, la coespressione, interattività e dimerizzazione delle rispettive proteine recettoriali di membrana (Matera et al. 2000; Pellegrini et al. 1992) e il fatto che l’indice proliferativo e la velocità di progressione delle popolazioni neoplastiche è direttamente proporzionale all’espressione recettoriale del GH stesso. La proliferazione cellulare è quindi strettamente dipendente dalla prolattina (Singh et al. 2006; Rillema et al. 1992; Russell & Laird 1989; Buckley et al. 1988; Davis & Linzer 1988; Gout et al. 1980), dal GH (Hooghe et al. .1998), e da molecole mitogeniche dipendenti dal GH e da esso positivamente regolate, come il fattore di crescita epidermico (EGF), il fattore di crescita dei fibroblasti (FGF), il fattore di crescita degli epatociti (HGF), il fattore di crescita simile all’insulina (IGF), il fattore di crescita neuronale (NGF), il fattore di crescita di derivazione piastrinica (PDGF), il fattore di crescita trasformante (TGF) e fattore di crescita endoteliale vascolare (VEGF); così come i fattori di crescita prodotti dal sistema gastrointestinale, come il Peptide Vasoattivo Intestinale (VIP), la Colecistochinina (CCK) e la Gastrina (G). (Matt et al. 2009; Trejo et al. 2004; Ferrara & Gerber 2002; Ornitz & Itoh 2001; Boonstra et al. 1995; Cos & Blask 1994; Comoglio, 1993; Lüscher et al. 1992; Heldin & Westermark 1991).
Sia la proliferazione cellulare fisiologica che quella neoplastica avvengono grazie a queste stesse molecole, che utilizzano anche le cellule neoplastiche, ma in modo esponenziale rispetto alle cellule sane. La perdita di differenziazione e la proliferazione incontrollata, seppur in misura diversa, caratterizzano tutte le neoplasie. L’uso della somatostatina e dei suoi analoghi, agendo sulla crescita, denominatore comune di tutti i tumori, è quindi un’indicazione razionale in tutti i tumori (Ruscica et al. 2012; Tejeda et al. 2008). Un’espressione recettoriale per la somatostatina è stata documentata in molti tumori, non solo nelle forme neuroendocrine (Hasskarl et al. 2011; Ferone et al. 2011; Keller et al. 2005; Dalm et al. 2004; Zhou et al. 2002; Oomen et al. 2000; Van den Anker-Lugtenburg et al. 1996; Lipp et al. 1995; Witzig et al. 1995; Reubi et al. 1992; Baschieri et al. 1989; Jakobs & Schultz 1983). È stata inoltre documentata la relazione causale e proporzionale tra l’espressione recettoriale del GH (di cui la somatostatina è l’antidoto biologico) e l’induzione e la progressione del tumore, utilizzando tecniche della biologia molecolare (PCR, Western Blot) e le tecniche istochimiche che hanno rivelato concentrazioni marcatamente superiori del recettore ormonale (GHR) nei tessuti tumorali rispetto ai tessuti sani (Lin et al. 2011; Gebre-Medhin et al. 2001). È ormai dimostrato che la progressione neoplastica sia strettamente dipendente dall’angiogenesi e dalla linfogenesi e che rappresentano uno stadio obbligatorio ed essenziale della malattia (Aggarwal et al. 2012; Bergers & Benjamin 2003; Greenblatt & Shubi 1968). L’acquisizione di un fenotipo angiogenico è determinante per l’espansione del tumore.
La somatostatina e i suoi analoghi regolano negativamente gli “induttori angiogenici” e tutti gli stadi dell’angiogenesi come la cascata dei monociti, l’interleuchina 8 (IL-8), la prostaglandina E 2 (PGE2) e VIP, l’ossido nitrico sintasi endoteliale (e-Nos) (Ribatti et al. 2007; Dasgupta, 2004; Arena et al. 2004; Florio et al. 2003; García de la Torre et al. 2002) così come i fattori di crescita il cui sinergismo è essenziale per l’angiogenesi, come l VEGF- A TGF, FGF, HGF e PDGF (Chekhonin et al. 2012; Woltering, 2003). L’inibizione dell’angiogenesi indotta da somatostatina è sinergicamente e fattorialmente rafforzata dagli altri componenti del MDB, come MLT, Retinoidi, Vitamina D 3, Vitamina C, inibitori della prolattina (agonisti dopaminergici) e componenti della matrice extracellulare come la galattosammina solfato. Allo stesso modo, l’effetto citostatico, antiproliferativo e antimetastatico della Somatostatina è efficacemente sinergizzato dagli inibitori della prolattina (Cabergolina e Bromocriptina) e dagli altri componenti della MDB come Retinoidi, MLT, Vitamina D3 Calcio, Vit E e Vit C. (Fujita et al. 2010; Singh et al. 2010; Trump et al. 2006; Trubiani et al. 2005; Chen et al. 2005; Guidoboni et al. 2005; Consolini et al. 2001; Dalen & Neuzil 2003; Darwiche ed altri 2001; Lissoni ed altri 2000; Sarna ed altri 2000; Bode ed altri 1999; Sundaresan ed altri 1997; Yu ed altri 1996,1997; Turley ed altri 1995; Defacque ed altri 1994; Drake ed altri 2010; Hickish ed altri 1993; Kao ed altri 1993; Thomas & Hoffman 1989; Haverty ed altri 1987).
Queste evidenze scientifiche hanno fornito la motivazione per la realizzazione di uno studio pilota sull’uso combinato di questi componenti in pazienti affetti da diverse forme di linfoma.
I risultati dello studio hanno permesso di confermare non solo la già nota attività antitumorale dei retinoidi (Kempf et al. 2003; Younes et al. 2000; Knobler et al. 1991) e delle vitamine D3 ed E in queste malattie linfoproliferative (Nieto- Rementería et al. 2009; Zhang et al. 2002; Drake et al. 2010), ma anche per rilevare una risposta marcata in termini di qualità della vita e totale assenza degli effetti collaterali spesso debilitanti che si verificano frequentemente con i trattamenti oncologici convenzionali. Fenomeni come leucopenia (Schmitz et al. 2012), trombocitopenia e immunosoppressione, attribuiti alla somministrazione di dosi massicce di chemioterapia, sono lievi e spesso assenti con l’uso concomitante di basse dosi (50 mg) di ciclofosfamide e molecole con un marcato attività trofica e mieloprotettiva, come MLT e Vitamine (Anwar et al. 1998; Heaney et al. 2008; Sarna & Bhola 1993; Prasad et al. 1992; Coleman et al. 2012; Prasad et al. 2010). Questa combinazione di farmaci e il basso dosaggio di chemioterapici favorisce l’alterazione del meccanismo d’azione della molecola alchilante da citolitico ad apoptotico, ottenendo vantaggi sia in termini farmacologici che di Performance Status.
CONCLUSIONI
L’obiettivo principale di questo approccio biologico (MDB) è quello di salvaguardare e ripristinare il microambiente biologico. L’azione riparatrice (omeostasi) si realizza mediante un’attività a due stadi, rafforzando da un lato la crescita cellulare ordinata e fisiologica (differenziazione) dei tessuti sani in opposizione alla crescita incontrollata e indistinta (indifferenziata) dei tessuti neoplastici. Queste azioni sono completate da quella antiossidante, antiradicalica libera, prodifferenziante (riconversione del tumore o delle cellule indifferenziate alla normalità), proapoptotica (che induce la cellula tumorale alla morte cellulare, con meccanismi fisiologici, non citotossici), immunostimolante (Melatonina e Vitamine), antiproliferativa ( Melatonina, Somatostatina, Inibitori della prolattina, Vitamine), e l’attività antimetastatica e, attraverso meccanismi diretti e indiretti, il rafforzamento dell’inibizione del fattore di crescita (Di Bella 2010).
Tabelle e Figure
File pdf della traduzione di MDB002 Di Bella et al. (2012) “Il Metodo Di Bella (MDB) ha migliorato sopravvivenza, la risposta obiettiva e il performance status in uno studio clinico osservazionale retrospettivo su 55 casi di linfomi – The Di Bella Method (MDB) improved survival, objective response and performance status in a retrospective observational clinical study on 55 cases of lymphomas”. Neuro Endocrinology Letters, 33(8):773-781