Uno studio osservazionale retrospettivo su casi di tumori cerebrali anaplastici trattati con il Metodo Di Bella: razionale ed efficacia. – A retrospective observational study on cases of anaplastic brain tumors treated with the Di Bella Method: A rationale and effectiveness.
Codice: MDB006
Autore: Di Bella et al.
Data: 2021
Rivista: Neuroendocrinology letters 42(7):464–483
Argomento: dati clinici del Metodo Di Bella
Accesso libero: si
DOI: PMID: 35490357
BLOG: https://www.metododibellaevidenzescientifiche.com/2022/12/30/mdb006-di-bella-et-al-2021/
Parole chiave: Glioblastoma; Tumori cerebrali; Metodo Di Bella; Acido retinoico; Somatostatina; Vitamina D; agonisti D2R; Melatonina; Vitamina E; prolattina; Fattore di crescita
Tumore: tumori cerebrali
Traduzione: tradotto l’intero articolo, con alcune minime semplificazioni.
Punti di interesse: Questo lavoro del dott. Di Bella e colleghi presenta i risultati ottenuti con il Metodo Di Bella su alcuni casi di tumore al cervello. Tre dei sette pazienti trattati con MDB sono ancora vivi dopo 5-6 anni e gli altri quattro pazienti sono ancora vivi dopo sette anni. In 3 casi, il MDB è iniziato dopo il fallimento del protocollo tradizionale, quando è stata rilevata la recidiva della malattia. Dopo il trattamento con MDB, la progressione della malattia è stata arrestata. Un paziente con glioblastoma con resezione chirurgica incompleta, ha adattato la MDB in prima linea e dopo otto anni il paziente è ancora vivo e non presenta né sintomi né progressione della malattia. Un paziente con una neoplasia gliale aplastica inoperabile ha iniziato la MDB come terapia di prima linea (nessun altro trattamento pregresso) durante la progressione del tumore. Dopo sette anni, il paziente non ha sviluppato recrudescenza ed è libero dal cancro. Il paziente con oligoastrocitoma inoperabile, non ha iniziato la terapia tradizionale e non ha subito un intervento chirurgico, è ancora vivo dopo otto anni senza progressione tumorale e conduce una vita normale, l’unica terapia è stata il Metodo Di Bella. Con i metodi tradizionali, generalmente la sopravvivenza a un anno è del 57%, scendendo al 16% a due anni e al 7% a tre anni. Il paziente con GBM che vive più di tre anni è descritto come “lungo sopravvissuto”.
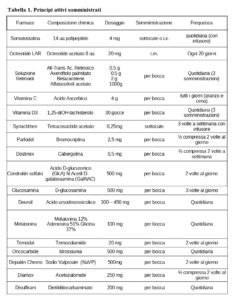
I principi attivi usati nel MDB per la cura dei tumori cerebrali sono somatostatina e analogo (octreotide), agonisti del recettore dopaminergico D2, acido tutto trans retinoico (ATRA), β-carotene, axeroftolo disciolto in vitamina E, vitamina D, vitamina C, melatonina (MLT), proteoglicani, glicosaminoglicani, acido valproico, acetazolamide, dietilditiocarbammato, idrossiurea e temozolomide. I componenti di questa terapia arrestano la crescita del tumore e migliorano la sopravvivenza dei pazienti con un tumore al cervello. Lo sviluppo della patologia tumorale è un processo a più fasi ed i trattamenti devono tener conto di questo. Le cellule staminali tumorali (CSC) dovono essere un target terapeutico in modo da fermare la progressione del cancro. Il Metodo Di Bella è stato ideato sulla base di queste considerazioni e per questo consiste nella somministrazione di diverse molecole specifiche. Ogni molecola viene scelta in base al suo meccanismo di azione contro cellule tumorali, le cellule staminali, proliferazione e apoptosi, oncogeni, angiogenesi e mutazione. Queste molecole sono state scelte per colpire il tumore in tutte le fasi della sua potenziale evoluzione, alcune molecole sono state scelte anche per i loro meccanismi di conservazione su cellule sane, integrità della membrana cellulare, conservazione del DNA e funzione mitocondriale.
Proprietà dei principi attivi
Somatostatina e suoi analoghi (octreotide), antiprolattinici (cabergolina/bromocriptina – agonisti del recettore dopaminergico D2): contrasto alla crescita
GH e prolattina (PRL)
La proliferazione cellulare, fisiologica o patologica, e la sintesi proteica sono strettamente dipendenti dall’interazione tra prolattina (PRL) e ormone della crescita (GH). Il GH è il principale induttore della crescita e principale mediatore della differenziazione cellulare postnatale nelle cellule somatiche in seguito al legame con il suo recettore, il GHR. I recettori del GH sono ampiamente distribuiti con concentrazioni variabili in diversi tipi di cellule, normali e neoplastiche. Più GHR sono espressi nelle cellule tumorali, più le cellule tumorali possiedono capacità invasive e metastatiche. Esistono inoltre diversi fattori di crescita che sono GH-dipendenti, come EGF, FGF, HGF, IGF1, VEGF, PDGF, e fattori di crescita specifici gastrointestinali (GI), come VIP, CCK, G.
Recettori di GH e PRL
Il recettore della prolattina (PRLR) e il recettore del GH (GHR) sono espressi insieme sulle membrane cellulari e, attraverso la loro fusione o scambio di parti possono interagire fisicamente e funzionalmente, amplificando le vie proliferative, quindi le possibili reazioni che possono innescare. È stato scoperto che GH e PRL hanno un ruolo chiave nello sviluppo e nella progressione dei tumori umani, specialmente nel cervello. L’induzione e la progressione del tumore sono positivamente correlate all’espressione di GHR-PRLR.
GH e IGF (Fattore di crescita insulino simile)
L’IGF-1 è fortemente dipendente dal GH, l’asse GH/IGF-1 è il principale mediatore della crescita somatica e hanno un ruolo cruciale nell’oncogenesi, inibendo l’apoptosi, e stimolando la produzione di altri fattori di crescita come EGF, FGF e VEGF-A.
Ulteriori ruoli di GH nella crescita tumorale
Il GH promuove la migrazione e l’invasività delle cellule tumorali attraverso la transizione endoteliale-mesenchimale (EMT) nelle cellule tumorali e l’attivazione di processi che portano alla distruzione della matrice extracellulare con promozione di invasività. Il GH è implicato anche nell’induzione di diversi geni angiogenici e per questo è un attivatore dell’angiogenesi tumorale (formazione di vasi sanguinei per nutrimento).
Somatostatina e GH: ruolo indiretto della somatostatina
Diversi studi hanno confermato l’efficacia antitumorale degli analoghi della somatostatina nel glioblastoma, principalmente inibendo il rilascio di GH e GHRH (fattore di rilascio del GH). La somatostatina e i suoi analoghi riducono il GH e i fattori di crescita GH-dipendenti, rendendo il loro uso scientificamente motivato per il trattamento di diversi tipi di cancro.
Somatostatina e recettori: ruolo diretto della somatostatina
In diversi tipi di cancro, non solo in quelli neuroendocrini, è ben documentata un’espressione del recettore della somatostatina. Quindi l’effetto antiproliferativo della somatostatina e degli analoghi della somatostatina avviene indirettamente inibendo le vie del GH e direttamente interagendo con i suoi recettori.
In conclusione, l’asse PRL/GH/IGF ha un ruolo di primo piano nella crescita maligna, fornendo un razionale per l’uso di agonisti del recettore anti-dopaminergico D2 in combinazione con antagonisti biologici del GH, come la somatostatina e i suoi analoghi. L’inibizione di tale asse sottoregola i fattori di crescita correlati al GH, inclusi IGF1 e 2, EGF, FGF, VEGF, PDGF e le relative vie di segnalazione. Si promuove quindi la non proliferazione e l’apoptosi per le cellule riceventi. Tutto questo è ben documentato nella ricerca di base da decine di anni, ma non è ancora tradotto in applicazioni medico-cliniche.
Disulfiram (inibitore dell’aldeide deidrogenasi)
L’enzima aldeide deidrogenasi è noto come marcatore delle cellule staminali del glioblastoma, è segno distintivo di prognosi sfavorevole nel GBM e in altre malattie tumorali. ALDH1A1 è una variante di questo enzima che è stato trovato regolarmente nelle cellule staminali del glioblastoma ed è associato a chemioresistenza, come in altri tumori.
Acido valproico (VPA)
Il VPA, un farmaco anticonvulsivante, ha dimostrato di avere attività antineoplastiche. Inibisce la condensazione cromatina (DNA) e facilitando l’accesso al DNA a tutti i fattori di trascrizione, differenzianti e citostatici. Modifica l’espressione dei geni coinvolti nella differenziazione, nella riparazione del DNA e nell’apoptosi. Regola, riducendolo, il processo di divisione cellulare, inducendo il blocco della divisione cellulare. Le cellule così bloccate in fase G1 si muovono verso la differenziazione e la successiva apoptosi. Clinicamente, la somministrazione di VPA con temozolomide ha portato a un aumento della sopravvivenza dei pazienti affetti da GBM.
Inibitori della carbonidrasi (acetazolamide (AAZ)
Le anidrasi carboniche (CAH), metalloproteine dello zinco, sono enzimi che catalizzano la rapida interconversione di anidride carbonica e acqua in acido carbonico, protoni e ioni bicarbonato. Dato che questi enzimi producono ed usano protoni e ioni bicarbonato, hanno un ruolo chiave nella regolazione del pH e nell’equilibrio dei fluidi in diverse parti del nostro corpo. Il Ca9 è un’isoforma di CAH, associata quasi esclusivamente ai tumori ed è coinvolta nella tumorigenesi. Ca9 è sovra-espresso in molti tipi di cancro ed è raramente presente nei tessuti sani. L’espressione di Ca9 è indotta dall’ipossia e dall’acidificazione, entrambe presenti nelle aree neoplastiche dei tumori solidi. L’inibizione del Ca9, mediata dall’acetazolamide (AAZ), contrasta il suo ruolo cancerogeno.
Melatonina
La melatonina (MLT) è un ormone naturale prodotto dalla ghiandola pineale. Ha proprietà antiossidanti, antietà e immunomodulanti, ha un ruolo rilevante nell’ematopoiesi, principalmente nella trombogenesi, nella regolazione dei leucociti e nella sintesi dell’emoglobina. Inoltre, la MLT ha un ruolo preminente nella perfusione e negli scambi gassosi emato-tessuti, prevenendo l’ischemia tissutale, l’acidosi e l’ipossia in ambiente neoplastico, con conseguente iper-espressione di geni oncogeni. Sono state documentate le rilevanti e non tossiche proprietà apoptotiche, oncostatiche, antiangiogeniche e antiproliferative della MLT su tutte le patologie neoplastiche.
Soluzione di retinoidi
I retinoidi sono composti chimici correlati alla vitamina A e sono fondamentali regolatori della proliferazione e la differenziazione cellulare. Svolgono un ruolo cruciale sia nella prevenzione che nella terapia del cancro. L’acido all-trans retinoico (ATRA) promuove la differenziazione, diminuendo il potenziale di proliferazione neoplastica, può sopprimere la trascrizione genica di fattori oncogeni, ha azione anti-angiogenica. La soluzione di retinoidi contiene non solo ATRA, ma anche axeroftolo palmitato (vitamina A), β-carotene e α-tocoferolo acetato. Questi costituenti potenziano le attività antitumorali di ATRA. La vitamina E ha anch’essa un’elevata attività antiossidante e anti-radicali liberi e influisce direttamente su un passaggio fondamentale dello scambio energetico: il trasporto di elettroni nella catena respiratoria. L’α-tocoferolo ha inibito la crescita di varie linee cellulari tumorali.
Vitamina C
L’acido ascorbico, o vitamina C, ha una grande attività antiossidante reagendo direttamente con i singoli atomi di ossigeno, idrossidi e radicali superossido. Biologicamente, la vitamina C agisce come vettore di idrogeno nel metabolismo intermedio, compresi i processi di respirazione cellulare. Inoltre, la vitamina C possiede attività terapeutiche antitumorali, inclusa l’attività anti-angiogenica e antimetastatica.
Vitamina D
La vitamina D è una molecola liposolubile che è principalmente responsabile dell’omeostasi del calcio. Tuttavia, la vitamina D ha molte funzioni biologiche, è una molecola importante per la differenziazione cellulare, induce la maturazione fenotipica delle cellule tumorali in cellule funzionalmente mature, differenziate e fisiologicamente normali, inibisce la proliferazione e previene la migrazione cellulare dalla membrana basale, inibisce l’angiogenesi inibendo il VEGF in modo dose-dipendente.
Proteoglicani e glicosaminoglicani
Il condroitin solfato è un glicosaminoglicano e viene utilizzato con glucosamina come integratore per l’osteoartrosi. Tuttavia, ci sono diversi studi che hanno dimostrato che il condroitin solfato ha attività antitumorali e antimetastatiche. La glucosamina solfato inibisce le cellule staminali del cancro, induce morte cellulare, sopprime la proliferazione cellulare e ha attività antinfiammatoria.
Il MDB, attraverso l’uso dei diversi principi attivi, sposta l’asse terapeutico dai meccanismi citolitici, tossici e immunosoppressivi al contrasto del tumore attraverso diversi meccanismi. Gli obiettivi multistrategici della MDB sono l’inibizione dell’invasività proliferativa e dell’angiogenesi neoplastica e il silenziamento del sistema di sopravvivenza attraverso componenti differenzianti, come la soluzione di retinoidi in vitamina E, MLT, vitamina C e D, ecc. Questi ultimi contrastano la capacità mutagena delle cellule tumorali grazie alla quale, in stress acuto, implementano sistemi di riparazione del DNA, esprimono o silenziano i geni, selezionando e conservando vantaggi vitali con estrema velocità ed efficienza. Questi stessi componenti hanno inoltre attività trofiche, immunomodulatorie e antiossidanti, migliorano la vitalità e l’efficienza delle cellule normali e deprimono l’efficienza e la vitalità di quelle neoplastiche. In questo modo si sposta l’asse terapeutico da un approccio citotossico e citolitico, con il fine utopico di una eradicazione totale nel lungo termine di tutte le cellule tumorali, a un ripristino dell’omeostasi immuno-neuro-endocrina. Una strategia più fisiologica che guarda alla riconversione delle funzioni vitali deviate delle cellule tumorali, alla differenziazione delle cellule tumorali e alla riprogrammazione delle cellule staminali tumorali. Si interviene quindi non solo sul sintomo, ma anche sulla causa stessa della malattia.
Traduzione articolo
Riassunto
Nonostante tutti i nuovi sviluppi nella terapia del cancro, l’aspettativa di vita dei pazienti con tumori cerebrali anaplastici maligni e glioblastoma multiforme (GBM) rimane breve. Dall’istituzione del Metodo Di Bella (MDB) nella terapia del cancro, il MDB è stato in grado di aumentare il tasso di sopravvivenza e la qualità della vita, senza tossicità conclamata, rispetto a quanto descritto in letteratura per analoghi tumori cerebrali, con la stessa caratteristiche immunoistochimiche, istologiche e cliniche. Pertanto, abbiamo trattato sette pazienti con tumori cerebrali anaplastici maligni utilizzando il protocollo MDB. La terapia MDB consiste in somatostatina e analogo (octreotide), acido tutto trans retinoico (ATRA), β-carotene, axeroftolo disciolto in vitamina E, vitamina D, vitamina C, melatonina (MLT), proteoglicani, glicosaminoglicani, acido valproico, acetazolamide, dietilditiocarbammato, idrossiurea e temozolomide. Queste molecole hanno caratteristiche antiproliferative, antiangiogeniche, citostatiche, antiossidanti, antimetastatiche (differenziative) e immunomodulanti. Inoltre, l’inclusione di ATRA, MLT e glucosamina con valproato di sodio, dietilditiocarbammato e acetazolamide ha rafforzato le proprietà antitumorali della terapia estendendole alle cellule staminali tumorali. Inoltre, il dosaggio metronomico non citolitico e non citotossico di idrossiurea e temozolomide ha aumentato l’esito della terapia MDB rafforzando la capacità antitumorale. I risultati di tale trattamento hanno rivelato che tutti e sette i pazienti erano ancora vivi dopo 5-8 anni dall’inizio della MDB. In conclusione, gli obiettivi multistrategici della MDB sono l’inibizione dell’invasività proliferativa e dell’angiogenesi neoplastica, il silenziamento del sistema di sopravvivenza delle cellule staminali tumorali, il potenziamento delle attività immunomodulatorie e antiossidanti, il miglioramento della vitalità e dell’efficienza delle cellule normali e la riduzione dell’efficienza e della vitalità di quelle neoplasticihe.
Abbreviazioni:
AAAZ – Acetazolamide
ATRA – Acido tutto trans retinoico
ALDH – Aldeide deidrogenasi
Ca 9 – Isoenzima di CAH
CAH – Anidrasi carbonica
CCK – Colecistochinina
C.M. – Chemiotassi indotta da GH dei Monociti
CSC – Cellule staminali tumorali
MDB – Metodo Di Bella
EGF – Fattore di crescita epidermico
EGFR – Recettore del fattore di crescita epidermico
FGF – Fattore di Crescita Fibroblastico
GBM – Glioblastoma Multiforme
gCSC – Cellule staminali tumorali di glioblastoma
GF – Fattore di crescita
GH – Ormone della crescita
GHR – Recettore dell’ormone della crescita
HDAT – Istone deacetilasi
HGF – Fattore di crescita degli epatociti
HIF-1α – Fattore oncogenico indotto dall’ipossia
IGF1-2 – Fattore di crescita insulino-simile 1-2
IGFR – Recettore del fattore di crescita insulino-simile
IL8 – Interleuchina 8
MRI – Imaging a risonanza magnetica
MLT – Melatonina
MGMT – O6-metil-guanina-DNA metiltransferasi
NGF – Fattore di crescita nervoso
NHL – Linfoma non Hodgkin
NOSe – Ossido nitrico sintetasi endoteliale
PDGF – Fattore di crescita derivato dalle piastrine
PET – Tomografia ad emissione di positroni
PG2 – Prostaglandina 2
PRL – Prolattina
PRLR – Recettore della prolattina
RMN – Imaging a risonanza magnetica
SSN – Servizio Sanitario Nazionale
SST – Somatostatina
SSTR – Recettore della somatostatina
TGF – Fattore di crescita trasformante
TRK – Tirosina chinasi
VEGF – Fattore di crescita endoteliale vascolare
VIP – Peptide intestinale vasoattivo
VPA – Acido valproico
INTRODUZIONE
I tumori cerebrali anaplastici maligni e il glioblastoma multiforme (GBM) rimangono un problema clinico irrisolto. Inoltre, il GBM è il tipo di cancro più frequente e aggressivo che colpisce diverse cellule gliali di un cervello adulto. Sebbene ci siano progressi nel trattamento del cancro, i tumori cerebrali maligni e i trattamenti di GBM non sono all’altezza. Ad esempio, il regime di Stupp è il principale trattamento di pazienti con astrocitoma anaplastico e GBM. Il regime consiste in un intervento chirurgico seguito da radioterapia. Tuttavia, la sopravvivenza mediana globale rimane 15-18 mesi dopo la diagnosi e non è migliorata significativamente nell’ultimo decennio (Delgado-López & Corrales-García 2016; Lakomy et al. 2020). Inoltre, la resezione totale (oltre il 98% del volume del tumore) aumenta la sopravvivenza rispetto alla resezione parziale o parziale. Al contrario, la resezione subtotale “estesa” non conferisce alcun vantaggio rispetto alla resezione parziale o alla biopsia (Laws et al. 2003). Generalmente la sopravvivenza a un anno è del 57%, scendendo al 16% a due anni e al 7% a tre anni (Filippini et al. 2008). Tuttavia, il paziente GBM che vive più di tre anni è descritto come “lungo sopravvissuto” e questa condizione è spesso limitata alla chirurgia di resezione subtotale.
Poiché lo sviluppo delle cellule tumorali è un processo a più fasi che coinvolge più segnali anomali e percorsi genetici, i trattamenti devono tener conto di questo processo in modo simile.
Inoltre, le cellule staminali tumorali (CSC) dovono essere un target in modo da fermare la progressione del cancro. Sulla base di queste considerazioni fu ideato il Metodo Di Bella (MDB) (Di Bella et al. 1979a; Di Bella et al. 1979b). Il MDB consiste nella somministrazione di diverse molecole specifiche, ogni molecola viene scelta in base al suo meccanismo di azione contro cellule tumorali, CSC, proliferazione e apoptosi, oncogeni, angiogenesi, analisi molecolare e mutazione genetica. Inoltre, alcune molecole sono state scelte per i loro meccanismi di conservazione su cellule sane, tra cui l’integrità della membrana cellulare, la conservazione del DNA e la funzione mitocondriale (Di Bella 2010). Da diversi anni utilizziamo il MDB per trattare con successo diversi tipi di cancro tra cui seno, testa e collo e molti altri (Di Bella et al. 1979a; DiBella et al. 1979b; Di Bella 1997; Di Bella & Di Bella 1998; Di Bella 2005; Di Bella & Gualano 2006; Di Bella 2010; Di Bella et al. 2013a; Di Bella et al. 2013b; Di Bella & Di Bella 2015; Di Bella et al. 2017; Di Bella et al. 2018; Di Bella 2019). Nel cancro al cervello, la percentuale di CSC è associata alla resistenza alla chemio e alla radioterapia, e quindi si verifica una rapida regressione della malattia. Poiché il protocollo MDB si rivolge a molte fasi dello sviluppo del cancro e al CSC, abbiamo trattato sette pazienti con tumori cerebrali anaplastici maligni e GBM. Inoltre, abbiamo menzionato come i componenti di questa terapia arrestano la crescita del tumore e migliorano la sopravvivenza dei pazienti con un tumore al cervello.
TRATTAMENTO MDB RAZIONALE PER TUMORI MALIGNI DEL CERVELLO
La terapia MDB per i tumori cerebrali consisteva nella somministrazione di più farmaci, vitamine e molecole come delineato nella Tabella 1. Ciascuno dei farmaci o vitamine o integratori utilizzati era basato sui nostri precedenti risultati clinici su diversi tipi di cancro (Di Bella et al. 1979a; Di Bella et al. 1979b; Di Bella 1997; Di Bella & Di Bella 1998; Di Bella 2005; Di Bella & Gualano 2006; Di Bella 2010; Di Bella et al. 2013a; Di Bella et al. 2013b; Di Bella & Di Bella 2015; Di Bella et al.2017; Di Bella et al.2018; Di Bella 2019).
Somatostatina ed analoghi della somatostatina
Nel metodo MDB, sono state utilizzate diverse molecole per arrestare la proliferazione e la crescita del cancro. Queste molecole sono state scelte sulla base della ricerca scientifica. Ad esempio, la proliferazione cellulare, fisiologica o patologica, e la sintesi proteica sono strettamente dipendenti dall’interazione tra prolattina (PRL) e ormone della crescita (GH). Il GH è il principale induttore della crescita (De Souza et al. 1974; Lincoln et al. 1998; Friend 2000; Barnett 2003; Anthony & Freda 2009). Il GH è anche il principale mediatore della crescita e della differenziazione cellulare postnatale nelle cellule somatiche in seguito al legame con il suo recettore, GHR (Le Roith et al. 2001; Zhu et al. 2001). Questo legame attiva percorsi cardine di crescita e sopravvivenza cellulare, con diverse vie di segnalazione (Le Roith et al .2001;Zhu et al.2001). D’altra parte, i GHR sono ampiamente distribuiti con concentrazioni variabili in diversi tipi di cellule, normali e neoplastiche. Più GHR sono espressi nelle cellule tumorali, più le cellule tumorali possiedono capacità invasive e metastatiche (Lincoln et al. 1994).
Esistono inoltre diverse molecole mitogene GH-dipendenti, come EGF, FGF, HGF, IGF1, VEGF, PDGF (Hagemeister & Sheridan 2008; Murray et al. 2004; Sall et al. 2004; Szepesházi et al. 1999; Taslipinar et al. al. 2009) e fattori di crescita specifici gastrointestinali (GI), come VIP, CCK, G (Kath & Höffken 2000) che sono coinvolti in molti tipi di cancro. Inoltre, il recettore della prolattina (PRLR) e il recettore del GH (GHR) sono co-espressi sulle membrane cellulari e, attraverso l’eterodimerizzazione, possono interagire fisicamente e funzionalmente, amplificando le vie proliferative (Kelly et al. 1993). È stato scoperto che GH e PRL hanno un ruolo chiave nello sviluppo e nella progressione dei tumori umani, specialmente nel cervello (De Souza et al.1974; Ben-Jonathan et al. 2002; Batra et al. 1997; Cameron et al. al.1979).
L’induzione e la progressione del tumore sono positivamente correlate all’espressione di GHR-PRLR, come dimostrato dall’immunoistochimica, dal Western blot, dall’ibridazione in situ e dalle analisi qPCR. È ben documentato che nei tessuti tumorali i livelli di GHR sono superiori rispetto a quelli fisiologici o peritumorali, a conferma del ruolo chiave mitogeno (Di Bella et al. 2018; Friend 2000; Gruszka et al. 2001; Lincoln et al. 1998; Zeitler & Siriwardana 2000). Sebbene i tempi esatti dell’eziopatogenesi non siano completamente compresi, è concepibile che la segnalazione autocrina e/o paracrina possa essere responsabile della produzione locale di GH, GHR, PRL, PRLR e IGFI in molti tumori, compresi quelli del sistema nervoso centrale.
L’IGF-1 è fortemente dipendente dal GH (Daughaday & Trivedi 1987). Inoltre, è ben noto che la somministrazione di GH provoca un aumento di IGF-1 nelle cellule tumorali umane. Una grande quantità di GHR è stata osservata in linee cellulari in crescita cellulare esponenziale e gli assi GH/IGF-1 sono il principale mediatore della crescita somatica e hanno un ruolo cruciale nell’oncogenesi (Laban et al. 2003), inibendo l’apoptosi (Kusano et al. 2014; Perry et al. 2006), e stimolando la produzione di EGF, FGF e VEGF-A (Cattaneo et al. 1999; Brunet-Dunand et al. 2009; Vacas et al. 2016).
Il GH promuove la migrazione e l’invasività delle cellule tumorali attraverso la transizione endoteliale-mesenchimale (EMT) nelle cellule tumorali e l’attivazione di processi che portano alla distruzione della matrice extracellulare (MMP2 e MMP9) (Mukhina et al., 2004; Sommers et al., 1994; Thiery, 2002). Il GH è implicato nell’induzione di diversi geni angiogenici, come l’ossido nitrico sintasi endoteliale (eNOS), il fattore di crescita dell’endotelio vascolare (VEGF), il fattore di crescita dei fibroblasti di base (bFGF), è un attivatore dell’angiogenesi tumorale. Con analisi immunoistochimiche, il GH determina un aumento della densità capillare e della proliferazione cellulare (Kusano et al. 2007).
Secondo alcuni studi, l’mRNA del GHR è stato trovato nelle cellule cerebrali sane e nel glioblastoma (Castro et al. 2000). La sovraespressione di GH e GHRH nei tessuti tumorali come il glioblastoma, la mammella, i polmoni e altri tessuti è ben documentata (Lincoln et al. 1998). Diversi studi hanno confermato l’efficacia antitumorale degli analoghi della somatostatina nel glioblastoma, principalmente inibendo il rilascio di GH e GHRH (Jaeckle et al. 2003; Kovács et al. 2010). La somatostatina e i suoi analoghi riducono il GH e i fattori di crescita GH-dipendenti, rendendo il loro uso adatto al trattamento di diversi tipi di cancro (Arena et al. 2007; Di Bella 2010; Di Bella et al. 1979; Friend 2000; Lachowicz-Ochedalska et al. . 2000; Lee et al. 2008; Pawlikowski et al. 1999; Pollak 1997; Verhoef et al. 2008; Vieira Neto et al. 2008). In diversi tipi di cancro, non solo in quelli neuroendocrini, è ben documentata un’espressione del recettore della somatostatina (Albérini et al. 2000; Borgström et al. 1999; Briganti et al. 1997; Cattaneo et al. 1999; Corletto et al. 2009; Edelmann et al. 2009; Faggiano et al. 2008; Florio et al. 2000; Florio 2008; Amico 2000; Fusco et al. 2008; Hassanen et al. 2010; Lui et al. 2009; Hubalewska-Dydejczyk et al. 2008; Ioannou et al. 2008; Khanna et al. 2008; Kögner et al. 1997; Kwekkeboom et al. 2008; Laclai et al. 2009; Li et al. 2008; Luboldt et al. 2010; Moertel et al. 1994; Orlando et al. 2001; Pisarek et al. 2009; Ruscica et al. 2010; Settini et al. 1996; Steták et al. 2001; van Eijck et al. 1998; Watt et al. 2008).
Inoltre, l’effetto antiproliferativo della somatostatina e degli analoghi della somatostatina avviene inibendo le vie del GH (Kiaris et al. 2005). La regressione e la lunga sopravvivenza con la somatostatina in un gliosarcoma primario, un tipo di GBM ma raro e con prognosi infausta, hanno confermato l’efficacia della somatostatina in questo tipo di patologia (Anthony & Freda 2009; Barnett 2003; De Souza et al. 1974; Friend 2000; Lincoln et al. 1998; Trignani et al. 2013).
In conclusione, l’asse PRL/GH/IGF ha un ruolo di primo piano nella crescita maligna, fornendo un razionale per l’uso di agonisti del recettore anti-dopaminergico D2 in combinazione con antagonisti biologici del GH, come la somatostatina e i suoi analoghi. L’inibizione di tale asse sottoregola il fattore di crescita mitogenico correlato al GH, inclusi IGF1 e 2 (Arena et al. 2007; Buckley & Buckley 2000), EGF (Barrie et al. 1993; Watt et al. 2008), FGF (Bonneterre et al. 1990), VEGF (Albini et al. 1999; Ashino et al. 2003; Cascinu et al. 2001) PDGF (Cattaneo et al. 1999) e le relative vie, con conseguente segnale antiproliferativo e pro-apoptotico per le cellule riceventi (Watt et al. 2008). Questo modo di vedere emergente è ben documentato nella ricerca di base, ma non è ancora tradotto in applicazioni cliniche.
Disulfiram (inibitore dell’aldeide deidrogenasi)
Abbiamo integrato il MDB con il disulfiram, un inibitore dell’aldeide deidrogenasi (ALDH), noto come marcatore delle CSC del glioblastoma (Toledo-Guzmán et al. 2019; Moreb 2008), che è coinvolto nel rinnovamento, differenziazione e autoprotezione (Marcato P et al. 2011; Marcato P et al. 2011). Le CSC di glioblastoma (gCSC) rappresentano la popolazione chimica resistente responsabile della recidiva, con una percentuale rilevante nella popolazione cellulare di glioblastoma. La temozolomide (TMZ), un agente alchilante, è un farmaco chemioterapico di prima linea, in grado di migliorare la sopravvivenza del paziente, e la sua resistenza porta al fallimento del trattamento (Schäfer A et al. 2012).
La sovraespressione di ALDH1A1, uno degli forme predominanti di ALDH (Nikhil et al. 2019), è segno distintivo di prognosi sfavorevole nel GBM e in altre malattie tumorali (Mazor et al.
2019). ALDH1A1 è stato trovato regolarmente nelle cellule staminali del glioblastoma ed è associato a chemioresistenza a TMZ (Moreb 2008).
Sono stati evidenziati i meccanismi biomolecolari che coinvolgono ALDH1A1. Nelle gCSC, la sovraespressione di ALDH1A1 aumenta la loro aggressività e resistenza, rendendole un bersaglio per strategie terapeutiche (Safa et al. 2016; Xu et al. 2015, Chen et al. 2019). In molti tipi di cancro, come carcinomi mammari e ovarici, neuroblastomi, retinoblastomi, ecc., è stata dimostrata la presenza di CSC e correlata alla sovraespressione del loro marcatore specifico ALDH1, portando a una prognosi infausta, maggiore aggressività e chemioresistenza (Flahaut et al. al. 2016; Kim et al. 2018; Marcato et al. 2011; Marcatto et al. 2011; Seigel et al. 2015). In questo contesto, l’introduzione nel MDB del disulfiram, un regolatore negativo dell’ALDH, è una scelta razionale. Inoltre il Disulfiram è ben tollerato senza alcuna tossicità al dosaggio di 200 mg al giorno.
Acido valproico
Il VPA, un farmaco anticonvulsivante, ha dimostrato di avere attività antineoplastiche inibendo l’istone deacetilasi e la condensazione della cromatina (Krauze et al. 2018) e consentendo l’accesso a tutti i fattori di trascrizione, differenzianti e citostatici (Rudà et al. 2016).
Inoltre, il VPA attiva i geni oncosoppressori (Garcia et al. 2018) e inibisce la proliferazione del glioma in vitro e in vivo, aumentando l’apoptosi e inducendo l’arresto del ciclo cellulare (Pan et al. 2017). Pertanto, il VPA è stato considerato una valida opzione terapeutica per il trattamento del GBM (Ishiguro et al. 2018). Il VPA modifica l’espressione dei geni coinvolti nella differenziazione, nella riparazione del DNA e nell’apoptosi. Come riportato in studi recenti, dopo il trattamento con VPA è emersa una riduzione dell’indice mitotico, a conferma dell’induzione del blocco della divisione cellulare nella fase G1. Comunemente, le cellule arrestate nella fase G1 si muovono verso la differenziazione e la successiva apoptosi (Riva et al. 2014). Clinicamente, la somministrazione di VPA con temozolomide ha portato a un aumento della sopravvivenza dei pazienti affetti da GBM (Kerkhof et al. 2013).
È stato dimostrato che il VPA contrasta la proliferazione e la mobilità delle gCSC (Gefroh-Grimes & Gidal 2016) e potenzia la risposta antitumorale con molti meccanismi, inclusa la differenziazione in diversi tipi di cellule tumorali (Rudà et al. 2016).
Inibitori della carbonidrasi
Le anidrasi carboniche (CAH), metalloproteine dello zinco, sono enzimi che possono avere rilevanza clinica nella terapia del cancro, a causa della loro isoforma specifica per la superficie cellulare. Il Ca9, un’isoforma di CAH, è associata quasi esclusivamente ai tumori ed è coinvolta nella tumorigenesi. Ca9 è sovra-espresso in molti tipi di cancro ed è raramente presente nei tessuti sani. L’espressione di Ca9 è indotta dall’ipossia e dall’acidificazione, entrambe presenti nelle aree neoplastiche dei tumori solidi (Winum et al. 2008; Said et al. 2010; Said et al. 2013; Supuran & Winum 2015). Inoltre, la sovraespressione di Ca9 rappresenta un indicatore significativo della prognosi della malattia, associata a maggiore aggressività, progressione maligna, metastasi e scarsa risposta al trattamento documentata in vari tumori (McDonald et al. 2019). Pertanto, l’inibizione del Ca9, mediata dall’acetazolamide (AAZ), contrasta il suo ruolo cancerogeno (Pastorekova et al. 2008).
Melatonina
La melatonina (MLT) è un ormone naturale prodotto dalla ghiandola pineale ed è associato al controllo del ciclo sonno-veglia (Auld et al. 2017). Inoltre, la MLT ha proprietà antiossidanti, antietà e immunomodulanti. La MLT ha un ruolo rilevante nell’ematopoiesi, principalmente nella trombogenesi, nella regolazione dei leucociti e nella sintesi dell’emoglobina. Inoltre, la MLT ha un ruolo preminente nella perfusione e negli scambi gassosi emato-tessuti, prevenendo l’ischemia tissutale, l’acidosi e l’ipossia in ambiente neoplastico, con conseguente iper-espressione di geni oncogeni, come HIF-1α. Sono state documentate le rilevanti e non tossiche proprietà apoptotiche, oncostatiche, antiangiogeniche e antiproliferative di questo indolo su tutte le patologie neoplastiche (Heldin & Westermark 1991; Cos et al. 1996; Lissoni et al. 1996; Bartsch & Bartsch 1997; Blask et al. Al. Pawlikowski et al. 1997; Lissoni et al. 2000; Czeczuga-Semeniuk et al. 2002; Reiter & Korkmaz 2008; Sanchez-Barceló et al. 2005; Skwarlo-Sonta 2002; Trubiani et al. 2005; Vijayalaxmi et al. 2004; Watanabe et al.2008; Fischer et al.2008; Bejarano et al.2009; Matt et al.2009; Ferreira Cda et al. 2010; Kim et al. 2013; Moradkhani et al. 2020). Clinicamente, la MLT ha mostrato potenzialità nel trattamento dei tumori solidi (Di Bella 2005; Di Bella & Gualano 2006; Di Bella et al. 2013a; Di Bella et al. 2013b; Nooshinfar et al. 2017; Talib 2018; Di Bella 2019; Gil-Martín. et al., 2019).
Soluzione di retinoidi
I retinoidi sono composti chimici correlati alla vitamina A. I primi studi avevano dimostrato che i retinoidi regolano la proliferazione e la differenziazione cellulare. Diversi studi hanno poi dimostrato che i retinoidi svolgono un ruolo cruciale sia nella prevenzione che nella terapia del cancro, limitando le conseguenze indotte dal cancro e dalle usuali terapie antitumorali (Abe et al. 2003; Adachi et al. 2001; Di Masi et al. 2015; Anthony & Freda 2009; Arany et al. 2003; Baroni et al. 2003; Basu et al. 2000; Chambaut-Guérin et al. 2000; Chou et al. 2000; Dufner-Beattie et al. 2001; Kim et al. 2009; Kini et al. 2001; Lee et al. 2008; Sharow et al. 2012; Song & Xu 2001; Wu et al. 2009; Ni et al. 2019; Ying et al. 2011).
Ad esempio, l’acido all-trans retinoico (ATRA) ha dimostrato di aiutare a differenziare i blasti nelle neoplasie ematologiche (Hassan HT & Rees J 1990), diminuendo il potenziale di proliferazione neoplastica e svolgendo un ruolo importante nella differenziazione cellulare, nell’apoptosi e nell’adesione (Herreros-Villanueva et al. 2015; Voigt et al. 2000). Inoltre, è stato dimostrato che l’acido retinoico può sopprimere la trascrizione genica di fattori oncogeni e promuovere l’effetto antiproliferativo (Arnold et al. 1994), ha azione anti-angiogenica (Majewski et al. 1994). Inoltre, l’acido retinoico e la temozolomide hanno arrestato la progressione del ciclo cellulare nella fase G0/G1 e hanno indotto significativamente l’apoptosi delle cellule di glioma umano (Shi et al. 2017).
Inoltre, è stato stabilito l’effetto dell’acido retinoico sulle gCSC. Le cellule staminali del glioblastoma (gCSC)sono note per essere le iniziatrici del tumore e il propagatore del tumore (Wang & Liu 2019; Songthaveesin et al. 2018). È stato stabilito che le cellule staminali del glioma si dividono simmetricamente, con conseguente scarso effetto terapeutico degli attuali trattamenti del glioma. Se le gCSC sono divise in modo asimmetrico, la capacità proliferativa del tumore contenente tali cellule diminuisce; In tal senso, è stato dimostrato che l’ATRA induce la divisione cellulare asimmetrica delle gCSC nella linea cellulare di glioblastoma U87MG. Questi risultati suggeriscono un effetto terapeutico dell’ATRA sulle cellule staminali del glioma (Wang & Liu 2019; Songthaveesin et al. 2018).
Come presentato nella Tabella 1, la soluzione di retinoidi contiene non solo ATRA, ma anche axeroftolo palmitato (vitamina A), β-carotene e α-tocoferolo acetato. Questi costituenti hanno anche potenziato le attività antitumorali di ATRA. Ad esempio, è stato dimostrato che la vitamina A causava la morte della cellula neoplastica per apoptosi, attraverso l’attivazione delle caspasi e la degradazione del fattore di trascrizione generale Sp-1 (Piedrafita & Pfahl 1997; Kanungo 2017). L’α-tocoferolo (vitamina E) ha invece un’elevata attività antiossidante e anti-radicali liberi e influisce direttamente su un passaggio fondamentale dello scambio energetico e della vita stessa: il trasporto di elettroni nella catena respiratoria. L’α-tocoferolo ha inibito la crescita di varie linee cellulari tumorali (Dalen & Neuzil 2003; Elattar & Virji 1999; Fariss et al. 1994; Heisler et al. 2000; Inokuchi et al. 2003; Israel et al. 2000; Malafa et al. al. 2000). .2000; Shklar & Schwartz 1996; Tang & Meydani 2001; Turley et al. 1995; Wu et al. 2002; Yamamoto et al.; Yu et al., 2002; Yu et al., 1997; Yu et al., 1997; Zhang et al., 2002). L’α-tocoferolo potenzia l’azione antitumorale di vari farmaci chemioterapici come adriamicina, cisplatino e tamoxifene (Prasad et al. 1994; Ripoll et al. 1986) e proteggeva le cellule del midollo osseo dagli effetti letali della doxorubicina (Fariss et al. 1994).
Vitamina C
L’acido ascorbico, o vitamina C, ha una grande attività antiossidante reagendo direttamente con i singoli atomi di ossigeno, idrossidi e radicali superossido (Padh 1991; Sauberlich 1994). Biologicamente, la vitamina C agisce come vettore di idrogeno nel metabolismo intermedio, compresi i processi di respirazione cellulare (Ngo et al. 2019; Pawlowska et al. 2019). Inoltre, la vitamina C possiede attività terapeutiche antitumorali (Cameron et al. 1979; Head 1998; Bendich & Langseth 1995; Aidoo et al. 1994; Lee et al. 2002; Blaszczak et al. 2019; Di Bella & Di Bella 1998; Ohno et al. 2009; van Gorkom et al. 2019), inclusa l’attività anti-angiogenica (Ashino et al. 2003) e antimetastatica (Peterkofsky 1991; Pinnel et al. 1987; Cameron & Pauling 1973; Utoguchi et al. 1995).
Vitamina D
La vitamina D è una molecola liposolubile che è principalmente responsabile dell’aumento dell’assorbimento intestinale del calcio e dell’omeostasi del calcio. Tuttavia, la vitamina D ha molte funzioni biologiche. Di questi, la vitamina D è una molecola importante per la differenziazione cellulare (Marcinkowska 2001; Consolini et al. 2001).
Inoltre, la vitamina D induce la maturazione fenotipica delle cellule tumorali in cellule funzionalmente mature, differenziate e fisiologicamente normali (Barroga EF et al. 2000; Majewski et al. 1994). È stato scoperto che la vitamina D3 inibisce la proliferazione e promuove la differenziazione di vari tipi di cellule tumorali e previene la migrazione cellulare dalla membrana basale. Quest’ultimo fenomeno era dovuto a una sottoregolazione delle integrine alfa-6 e beta-4, recettori della laminina associati alla massima migrazione cellulare e all’invasività delle cellule tumorali prostatiche in vivo (Yudoh et al. 1999; Sung & Feldman 2000). Inoltre, la vitamina D ha inibito l’angiogenesi inibendo il VEGF in modo dose-dipendente (Mantell et al. 2000). L’espressione dei recettori della vitamina D nei tumori del glioma è associata ad un aumento della sopravvivenza (Cataldi et al. 2020; Norlin 2020). La 1,25 idrossivitamina D3 e il suo analogo sopprimono la proliferazione e la migrazione nelle linee cellulari del glioma, esprimendo i recettori della vitamina D umana (Norlin 2020).
Proteoglicani e glicosaminoglicani
Condroitin solfato
Il condroitin solfato è un glicosaminoglicano solfato (GAG) composto da una catena di zuccheri alternati (N-acetilgalattosamina e acido glucuronico). Viene utilizzato con glucosamina come integratore per l’osteoartrosi. Tuttavia, ci sono diversi studi che hanno dimostrato che il condroitin solfato ha attività antitumorali e antimetastatiche (Fthenou et al. 2009; Kasten et al. 2018; Shi et al. 2021). È stato scoperto che il condroitin solfato ha inibito la crescita di una linea cellulare di cancro alla vescica mediante l’attivazione delle caspasi 3 e 9 e quindi inducendo l’apoptosi (Ferro et al. 2012). Inoltre, è stato dimostrato che il condroitin solfato ha migliorato la sopravvivenza dei topi portatori di carcinoma ovarico (Hamada et al. 2012).
Glucosamina solfato
Simile al condroitin solfato, la glucosamina viene utilizzata come integratore per l’osteoartrosi. Inoltre, diversi studi hanno dimostrato il potenziale della glucosamina solfato nel trattamento del cancro principalmente inibendo il CSC (Hosea et al. 2018; Hong et al. 2020). Inoltre, è stato riportato che la glucosamina ha indotto la morte cellulare autofagica attraverso la stimolazione dello stress del reticolo endoplasmatico (ER) nelle cellule di glioma umano (Hwang & Baek 2010). Inoltre, la glucosamina ha soppresso la proliferazione della linea cellulare di cancro alla prostata umana DU145 attraverso l’inibizione di specifiche vie di segnalazione (Chesnokov et al. 2014).
Inoltre, è stato documentato che la glucosamina ha attività antinfiammatoria (sopprime la produzione di citochine infiammatorie) (Dalirfardouei et al. 2016). Pertanto, può essere utilizzato nel trattamento dei tumori indotti da infiammazione (Al-Hanbali et al. 2009; Mansour et al. 2018).
Alcuni studi hanno presentato l’effetto tossico della glucosamina sulle cellule tumorali e ne hanno evidenziato l’applicazione nel targeting del glioma. Lo studio ha rivelato un effetto significativo sulla citotossicità e sull’apoptosi in vitro come valutato su linee cellulari di glioma di grado IV resistenti (Yadav et al. 2019).
L’IMPORTANZA DELLE COMBINAZIONI
Anche se ci sono dei motivi per utilizzare ogni molecola in MDB, l’effetto sinergico della combinazione la rende più potente. Ad esempio, l’effetto sinergico di MLT e VPA potenzia l’effetto citotossico di TMX nelle cellule GBM attraverso la riduzione dell’espressione di MGMT (Di Bella et al. 2013a; Di Bella et al. 2013b; Lissoni et al. 1996; Rudà et al. 2016), e quindi aumentare l’aspettativa di vita come visto nei nostri pazienti (Zhang et al. 2016). Inoltre, la combinazione di inibitori della CAH con trattamenti chemioterapici per il glioblastoma ha aumentato la sopravvivenza.
Abbiamo notato che l’integrazione di AAZ in un contesto multiterapeutico ha contribuito a ridurre la somministrazione di cortisone per le sue proprietà diuretiche e anti-edemigene. Inoltre, la somministrazione di AAZ e VPA ha ridotto gli episodi epilettici e migliorato la prognosi.
L’interazione tra MLT e altre molecole MDB si oppone a diversi processi che caratterizzano il fenotipo neoplastico, la mutazione e la proliferazione, la progressione e/o la disseminazione. Tutte queste caratteristiche suggeriscono l’uso di questa molecola come trattamento per il cancro (Di Bella et al. 2017; Gil-Martín et al. 2019; Nooshinfar et al. 2017; Taleb 2018).
Numerosi articoli di ricerca confermano l’attività preventiva e terapeutica della vitamina D nelle patologie neoplastiche (Jeon & Shin 2018). Vari analoghi sintetici della vitamina D, chiamati deltanoidi, sono progettati specificamente per potenziare l’attività antiblastica e allo stesso tempo ridurre diversi effetti collaterali (Negri et al. 2020). Il sinergismo di vitamina D, vitamina C, vitamina E e MLT è stato trovato in diversi studi clinici, mostrando le loro proprietà antiproliferative, antiangiogeniche e differenziative.
Inoltre, ipotizziamo che la combinazione di calcitriolo e ATRA (acido all-trans retinoico) e temozolomide potrebbe essere un approccio più sicuro per beneficiare della vitamina D nella gestione del cancro del glioma ad alto grado. L’aggiunta di acetazolamide a questo protocollo può ridurre il rischio di pseudotumori cerebrali, perché la vitamina D e un eccesso di vitamina A possono portare a ipertensione endocranica; questo approccio può fornire benefici grazie all’attività antitumorale dell’acetazolamide (Elmaci et al. 2019).
PAZIENTI TRATTATI CON TUMORI MALIGNI DEL CERVELLO
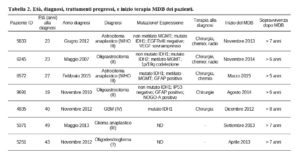
L’età del paziente, la diagnosi e il trattamento iniziale utilizzato prima della MDB sono riassunti nella Tabella 2. Di seguito è riportato un briefing su ciascun caso e i risultati del follow-up dopo la MDB.
ID paziente: 5833
Data di nascita: 29/07/1989
DIAGNOSI 20/06/2012 (23 anni) ASTROCITOMA ANAPLASTICO (WHO III)
non metilato-MGMT; IDH1 mutato; EGFRvIII negativo; VEGF sovraespresso.
20/06/2012 – RESEZIONE CHIRURGICA (lesione occupante spazio bilobata, circa 4 cm)
26/07/2012 – RMN cerebrale: “…piccolo residuo della parte più caudale della lesione gliale parietale sinistra…”
30/07/2012 – RT + TMZ 135 mg (fino al 06/11/2012)
21/11/2012 – TEM 370 mg/12 corsi
27/12/2012 – PET: “…area nodulare ipodensa, caudalmente alla cavità chirurgica, in regione parietale sinistra…”
05/03/2013 – RMN cerebrale: “…residuo di malattia lungo i bordi della apparentemente cavità chirurgica stabile, anche se i valori di rCBV sono aumentati rispetto alla scansione precedente…”
05/10/2013 – MRI cerebrale: “…ulteriore alterazione del segnale localizzata nella corona radiata parietale sinistra, sospettata di essere una lieve progressione di malattia infiltrativa…”
05/11/2013 – INIZIO MDB
20/06/2014 – RMN cerebrale: “…inalterata la morfologia e l’estensione del residuo di malattia infiltrativa lungo il margine inferiore della cavità chirurgica… inalterata anche la piccola area di alterazione del segnale localizzata nella corona radiata parietale sinistra “
25/06/2014 – PET: “…riduzione della captazione del radiocomposto nell’area nodulare ipodensa, precedentemente riportata caudalmente alla cavità chirurgica nella regione parietale sinistra…”
29/12/2017 – PET: “…la PET-TAC non ha evidenziato anomalie nella distribuzione del tracciante aminoacidico che possano essere correlate con certezza ad una patologia neoplastica…”
23/03/2018 – RMN cerebrale: “ …la morfologia e le dimensioni della cavità chirurgica sono inalterate… anche le aree di alterazione del segnale sono inalterate, iperintensità T2/FLAIR ai bordi della cavità, senza captazione del mezzo di contrasto. Nessun aumento documentato dei valori di rCBV a queste alterazioni…”
18/10/2018 – RM: diagnosi inalterata
10/06/2019 – MRI: diagnosi di malattia stabile con risultati MRI principali inalterati
10/01/2020 – PET-TC: “…non ha mostrato anomalie nella distribuzione del tracciante aminoacidico che potrebbero essere correlate a una malattia neoplastica, in particolare ai bordi della resezione chirurgica nella regione parietale sinistra. Nessuna ulteriore area di assorbimento focale di 11C-metionina nelle regioni corticali e sottocorticali e negli emisferi cerebrali.
26/06/2020 – MRI cerebrale: diagnosi di malattia stabile con referti MRI principali inalterati.
26/06/2020 – RMN cerebrale con mezzo di contrasto: “…
mostra un aumento non significativo della perfusione in alcune ROI e picchi di colina in alcuni voxel alla spettroscopia. Nessun miglioramento significativo dopo l’agente di contrasto. Terminato a causa dell’assenza di malattia ricorrente.
10/10/2020 – Esame istologico: “Frammento di epitelioma squamoso in situ (pTis UICC 2017)”
ID paziente: 6245
Data di nascita: 04/12/1982
DIAGNOSI 21/05/2007 (25 anni)
OLIGOASTROCITOMA (OMS II)
IDH1 non mutato; IDH2 mutato; metilato-MGMT; Codelezione 1p/19q
21/05/2007 – 1a RESEZIONE CHIRURGICA 31/05/2013 2a RESEZIONE CHIRURGICA (1a recidiva)
21/10/2014 – 3a RESEZIONE CHIRURGICA (2a recidiva) – RX + TEM 75 mg
25/11/2014 – INIZIO MDB
20/07/2015 – RMN cerebrale: “…nessuna alterazione patologica evidenziata nelle sequenze eseguite dopo somministrazione di Gadolinio…”
30/03/2016 – RMN cerebrale: “…reperti sostanzialmente inalterati…”
21/11/2017 – RMN cerebrale: “…reperti sostanzialmente inalterati…”
02/05/2018 – RM cerebrale: “…reperti sostanzialmente inalterati…”
27/11/2018 – RMN cerebrale: “…reperti sostanzialmente inalterati…”
22/05/2019 – Risonanza magnetica cerebrale: “diagnosi neuroradiologica stabile rispetto al precedente”
12/05/2020 – MRI cervello e tronco encefalico: diagnosi stabile
13/05/2020 – Visita Oncologica: “Alla luce del recente riesame strumentale che ha documentato una significativa stabilità di malattia, e condizioni cliniche generali ottimali e stabili, si raccomanda di continuare a monitorare il paziente”
18/11/2020 – Risonanza magnetica cervello e tronco encefalico: “I risultati di oggi appaiono del tutto inalterati. […] Tutti i restanti reperti sono sostanzialmente inalterati.”
ID paziente: 6572
Data di nascita: 21/02/1988
DIAGNOSI 02/02/2015 (27 anni) ASTROCITOMA ANAPLASTICO (WHO III)
Mutato-IDH1; metilato-MGMT; GFAP positivo 16/01/2015 – RESEZIONE CHIRURGICA (no sedute TC/2 RT)
27/02/2015 – RMN cerebrale: “…si osserva area residua centimetrica di iperintensità T1 e ipointensità T2 con edema diffuso. Adiacente al reperto precedente, area millimetrica delle iperintensità T1 nonché area potenziata dopo mezzo di contrasto…”
Successivamente CRISI – CEFALEA IN PROGRESSIVO PEGGIORAMENTO – STATUS EPILEPTICUS PARZIALE
PROPOSTA NUOVA CHIRURGIA seguita da RT – TMZ
16/03/2015 – Inizio MDB
20/04/2016 – RMN cerebrale: “…leggermente meno evidente, la piccola area di alterazione del segnale si riferisce alla lesione residua dopo mezzo di contrasto…”
03/10/2017 – RM cerebrale: “…nessun enhancement patologico dopo somministrazione del mezzo di contrasto…”
02/07/2018 – RM cerebrale: “…Nessuna area di enhancement patologico attribuibile a residui/recidive mostrato…”
06/02/2019 – RMN cerebrale: “I reperti sono sostanzialmente inalterati… non si osservano aree significative di enhancement patologico”
09/10/2019 – RMN cerebrale: “rispetto alla precedente scansione del 30/01/19: reperti inalterati; regione frontale sinistra con un’area di iperintensità T2. Il corno frontale del ventricolo laterale sinistro rimane largo. L’imaging di diffusione e perfusione non mostra aree di riduzione dell’ADC e aumento di rCBV nella suddetta area di iperintensità T2. I restanti reperti sono inalterati, in particolare nell’area malacica che interessa l’emisfero cerebrale destro e la cavità ischemica talamica sinistra, così come il probabile nodulo di eterotopia della sostanza grigia lungo la parete della camera del ventricolo laterale destro. Nessuna area di miglioramento patologico dopo l’agente di contrasto.
15/07/2020 – Risonanza Magnetica Cervello: “Rispetto all’esame osservato il 09/10/2019, i risultati della risonanza magnetica basale e post-contrasto sono perfettamente confrontabili.
Attualmente non si osservano immagini coerenti con la recidiva neoplastica”.
ID paziente: 9691
Data di nascita: 20/11/1991
DIAGNOSI: 30/11/2010 (19 anni)
OLIGOASTROCITOMA (OMS II)
IDH1 non mutato; IP53 negativo; GFAP positivo; NOGO-A positivo
16/11/2010 1a RESEZIONE CHIRURGICA (massa 5 cm)
15/02/2013 – 2° RESEZIONE CHIRURGICA (recidiva) – diagnosi: OLIGODENDROGLIOMA WHO II
10/06/2013 – RMN cerebrale: “…lesione residua…”
08/07/2014 – RMN cerebrale: “… l’estensione della lesione residua è inalterata, ma l’imaging di diffusione mostra un aumento dell’ADC di 2 volte rispetto alla sostanza bianca, e anche la perfusione mostra un valore di rCBV che è 5 volte quello della sostanza bianca di riferimento…”
GIUDICATO INOPERABILE (PARALISI DEL PIEDE DESTRO – DEPRESSIONE – CLONUS)
08/08/2014 – Prima revisione: Prof. Giangasparo – Umberto I – Policlinico di Roma: ASTROCITOMA ANAPLASTICO DI GRADO 3
18/08/2014 – Inizio MDB
28/08/2014 RM cerebrale: “…lieve aumento dell’estensione dell’area di alterazione del segnale, iperintensa sulle sequenze T2 pesate, a carico del tessuto nervoso circostante la ferita chirurgica, che sembra infiltrarsi controlateralmente attraverso il tronco del corpo calloso…”
11/09/2014 – Seconda Revisione Ist. Besta di Milano [Istituto Besta di Milano] di reperti istologici del 2010 e 2013. DIAGNOSI: (2010) OLIGOASTROCYTOMA – (2013) ASTROCYTOMA ANAPLASTICO Grado 3
16/09/2014 – 31/10/2014 – RT (33 sedute): Trattamento chemioterapico rifiutato.
03/12/2014 – MRI cerebrale: “…le dimensioni e le caratteristiche del segnale nell’area delle iperintensità T2 sono sostanzialmente inalterate…”
03/06/2015 – MRI cerebrale: “…l’area delle iperintensità T2 è sostanzialmente comparabile… l’imaging di diffusione lo mostra nell’area dell’alterazione del segnale. Valori ADC aumentati
(2.6) rispetto alla sostanza bianca (1); imaging di perfusione non rileva valori significativamente aumentati di rCBV”
09/09/2015 – RMN cerebrale: “…non si osservano aree di contrasto patologico dopo somministrazione del mezzo di contrasto…”
22/11/2016 – MRI cerebrale: “…reperti inalterati… imaging di diffusione e perfusione non mostrano aree di riduzione ADC o aumento rCBV…”
28/03/2017 – Risonanza magnetica cerebrale: “…la diagnosi resta stabile…”
01/09/2017 – PET: “nessuna area di captazione significativa alla lesione nota, delineata nella risonanza magnetica del 29/03/2017, nell’emisfero frontale posteriore parasagittale sinistro…la scansione non ha evidenziato la presenza di aree di captazione radiofarmaceutica patologica che potrebbe essere correlata alla malattia primaria…”
Il paziente ha ridotto di propria iniziativa le dosi del medicinale, a cui sono seguite alcune crisi epilettiche e peggioramento delle condizioni generali.
31/07/2018 – Risonanza magnetica cerebrale: “…reperti radiologici stabili…nessuna apparente recidiva della nota lesione occupante spazio dalla loro storia medica…”
Ripresa del trattamento per infusione endovenosa di somatostatina a dosi piene, risoluzione delle crisi epilettiche. Miglioramento della qualità della vita.
09/07/2020 – RM encefalo: “Rispetto alla precedente RM del 20/02/2020 si osserva l’insorgere di un’area di aumento di contrasto patologico in regione intraassiale parietale sinistra, verosimilmente neoplastica a morfologia irregolare e di circa 20 mm di diametro diametro. L’imaging di perfusione mostra valori di rCBV che sono aumentati di 3 volte in quest’area di aumento patologico rispetto a quelli della sostanza bianca controlaterale, probabilmente in relazione a segni di neoangiogenesi. Un piccolo edema perilesionale è associato a quest’area di enhancement patologico. Aumento dell’estensione dell’area nota di alterazione del segnale altofrontale sinistro […] posterosuperiormente alla nota cavità chirurgica, si osservano valori di rCBV aumentati di 2/3 volte rispetto a quelli della sostanza bianca controlaterale. Rispetto alla precedente scansione MRI sopra menzionata, si osserva l’insorgenza di più aree piccole e marcatamente ipointense nella stessa area sulle immagini GE pesate in T2 *, come la presenza di emosiderina, sospettata di essere più piccoli cavernomi indotti da radiazioni. La morfovolumetria del sistema ventricolare e la dimensione degli spazi subaracnoidei della convessità e della base sono sostanzialmente inalterate.
21/10/2020 – RMN cerebrale con mezzo di contrasto: “…si osserva una lieve riduzione dimensionale nell’area nota di contrasto patologico, di morfologia irregolare e nella regione parietale sinistra, con diminuzione dell’associato edema perilesionale. L’imaging di perfusione mostra valori di rCBV persistenti e attualmente aumentati di 5 volte in quest’area di miglioramento patologico rispetto a quelli della sostanza bianca innocua controlaterale, come la neoangiogenesi. La spettroscopia documenta un leggero aumento dei composti di colina in questa regione e una moderata riduzione di NAA rispetto al campionamento omologo raccolto dalla regione controlaterale, senza alterazione del segnale. L’estensione dell’area frontale superiore sinistra di alterazione del segnale è sostanzialmente inalterata, con iperintensità T2/FLAIR, che circonda la cavità chirurgica e si estende al centro semiovale sottostante e alla corona radiata: in quest’ultima i valori di rCBV rimangono significativamente poco definiti, più evidenti accanto alla ventricolo laterale. La morfovolumetria ventricolare e il restante reperto sono stabili, in assenza di nuove aree di contrasto patologico.”
La sospensione dei componenti essenziali della cura avviata dal paziente in questi giorni ha provocato una grave progressione della malattia.
ID paziente: 4835
Data di nascita: 26/05/1972
DIAGNOSI: 15/11/2012 (40 anni)
GLIOBLASTOMA (WHO IV) (con una parte periferica di astrocitoma diffuso) IDH1 mutato
15/11/2012 – RESEZIONE CHIRURGICA INCOMPLETA (70/80%): “…si asportano le grosse parti laterali e anteriori. La parte neoplastica infiltrante le regioni premotoria-motoria e controlaterale viene lasciata in situ. Si stima il 70/80% della rimozione del tumore…”
18/12/2012 – INIZIO MDB
04/01/2013 – RM: “…lesione residua nota in regione paramediana frontale sinistra le cui caratteristiche di segnale, area di infiltrazione e contrasto non appaiono sostanzialmente alterate rispetto alla precedente scansione…”
09/11/2015 – RM: “…i reperti radiologici appaiono sostanzialmente inalterati… in particolare è ancora significativa la nota lesione occupante spazio localizzata al giro del cingolo, che interessa entrambi gli emisferi…” “…
non si osservano aree di enhancement patologico intra o extraparenchimale né a livello della lesione né del rimanente parenchima sub e sopratentoriale dopo somministrazione del mezzo di contrasto…”
29/04/2016 – MRI: “…le dimensioni e le caratteristiche segnaletiche della nota lesione occupante spazio situata al giro del cingolo, che interessa entrambi gli emisferi, rimangono sostanzialmente inalterate…”
02/11/2016 – RMN: “…all’esame odierno, dopo somministrazione del mezzo di contrasto, la suddetta area poco definita di contrasto in corrispondenza della lesione in regione paramediana destra, appare meno evidente…”
15/ 02/2018 – RM: “…non si rilevano segni di recidiva locoregionale a seguito dell’asportazione del glioblastoma precedentemente localizzato al giro del cingolo con interessamento biemisferico…”
29/05/2019 Risonanza Magnetica: “…non si osserva l’insorgenza di segni di recidiva di malattia locoregionale… I restanti reperti sono inalterati…”
19/03/2020 – Risonanza magnetica cerebrale: “assenza di enhancement attribuita a segni di recidiva di malattia. La leucomalacia diffusa persiste al centro semiovale e nella regione periventricolare, inalterata rispetto alla precedente scansione.
Sistema ventricolare sub e sopratentoriale di normale morfologia, volume e localizzazione. Lieve allargamento degli spazi fluidi della volta. Anomalia venosa dello sviluppo nella regione cerebellare sinistra. Nessun miglioramento patologico intra ed extra-assiale rilevato dopo l’agente di contrasto.
Ispessimento della mucosa del seno mascellare sinistro. Ipertrofia dei turbinati.
ID paziente: 5371
Data di nascita: 22/06/1964
DIAGNOSI: 06/05/2013 (49 anni) TUMORE ANAPLASTICO GLIALE PROGRESSIVO, GLIOMA INFILTRANTE DI III GRADO
L’ANALISI MOLECOLARE SULLE MUTAZIONI NON È MAI STATA EFFETTUATA
06/05/2013 – RM: “…tumore cerebrale esteso che coinvolge l’intera giunzione bulbo-midollare con diffusione ai peduncoli cerebellari inferiori, peduncolo cerebellare medio destro, ed infiltrazione del 4° ventricolo su cui già determina l’effetto massa. ..”
10/09/2013 – INIZIO MDB
DIAGNOSI “Tumore gliale anaplastico progressivo, glioma infiltrante di grado III”, esacerbata dalla massima dignità funzionale dell’area interessata, percorsa da 10 nervi cranici, dal 3° al 12° (esclusi i nervi ottico e olfattivo) e il 4° ventricolo, sede di i centri vitali nervosi, respiratori e cardiovascolari che possono essere facilmente resi inattivi dalla compressione (per progressione tumorale e/o edema cerebrale postoperatorio o post terapeutico). La posizione e l’estensione hanno causato paresi e disabilità. Un Consulente Tecnico d’ufficio, a cui il paziente aveva chiesto di ottenere il MDB, ha escluso radioterapia, operazione e ha confermato la possibilità di cure palliative con prognosi inferiore all’anno.
La MDB ha ottenuto la remissione nella maggior parte del tumore e la stabilità, bloccando la progressione delle cellule tumorali residue che non proliferano più, consentendo finalmente il recupero funzionale e l’autosufficienza in un paziente precedentemente noto per disabilità e assistenza.
29/01/2019 – RMN cerebrale: “permane stabile l’estensione dell’infiltrazione neoplastica rilevata a livello della regione bulbocervicale, bilateralmente con aumento di volume delle strutture anatomiche interessate e alterazione disomogenea del segnale”.
17/04/2019 – FDG-PET: “rispetto alla RM del 29/01/2019: si rileva la presenza di uptake del tracciante metabolico disomogeneo, con vari gradi di captazione da lieve a moderata all’alterazione rilevata alla RM. La captazione è segnalata per essere più accentuata sul lato destro. Inoltre, nella colonna di destra si rileva un uptake moderato-severo, di significato incerto (aspecifico? Altro?); valutazione utile in campo caratterizzato. Non c’è altro da segnalare nelle restanti regioni corporee esaminate, in particolare nel parenchima polmonare e nel fegato. I risultati della PET suggeriscono la presenza di tessuto eteroplastico con moderato metabolismo dei carboidrati alla giunzione bulbocervicale e al segmento prossimale del midollo cervicale. N.B. nella regione ipermetabolica, l’attività è definita lieve-moderata-grave rispetto all’attività metabolica epatica, ai sensi delle linee guida EANM.
ID paziente: 5251
Data di nascita: 06/03/1969
DIAGNOSI: Novembre 2012 (43 anni) L’ANALISI MOLECOLARE SULLE MUTAZIONI NON È MAI STATA EFFETTUATA
17/12/2012 – ANGIOGRAMMA TC e RM: evidenziano un tumore a “tendenza progressiva” (rispetto a una RM del 2006 in cui si nota poco, tanto da non essere all’epoca presa in considerazione), con gravi vascolarizzazione e aderisce strettamente all’arteria silviana, quindi “l’intervento chirurgico non è raccomandato”. Considerate le caratteristiche di progressione e i reperti spettroscopici e di perfusione, l’ipotesi diagnostica pone GANGLIOGLIOMA o OLIGODENDROGLIOMA o OLIGOASTROCYTOMA.
19/04/2013 – INIZIO MDB
20/03/2014 – RM: “…si conferma la presenza di una lesione occupante spazio, di dimensioni 1,95 x 1,59 cm… con lieve enhancement dopo mezzo di contrasto…”
20/03/2014 – PET: “…la lesione, composta da porzioni solide e calcificate, non presenta modifiche sostanziali rispetto a quanto precedentemente documentato…”
09/11/2015 – PET: “…la scansione non mostra aree di captazione patologica del tracciante e, in particolare, la lesione precedentemente riportata, che appare caratterizzata da una grossolana calcificazione a conchiglia e senza un edema perilesionale che potrebbe essere correlato a meningioma calcificato”
17/10/2017 – RM: “…l’ecografia non ha evidenziato l’evoluzione della lesione temporosilviana sinistra…”
22/11/2018 – RM: “…lesione completamente stabile…”
27/10/2020 – RM cerebrale, imaging di perfusione e spettroscopia: “La lesione temporosilviana sinistra rimane completamente inalterata, con estese parti calcificate e un più piccolo parenchimatoso parte.”
RISULTATI DEL PROTOCOLLO MDB
Tre dei sette pazienti trattati con MDB sono ancora vivi dopo 5-6 anni e gli altri quattro pazienti sono ancora vivi dopo sette anni dall’inizio della MDB (Tabella 2). In 3 casi (Ids 5833, 6245, 6572), il MDB è iniziato dopo il fallimento del protocollo Stupp, cioè quando è stata rilevata la recidiva della malattia. Dopo il trattamento con MDB, la progressione della malattia è stata arrestata.
Il paziente con GBM (ID 4835) ha avuto una resezione chirurgica incompleta, quindi ha adattato la MDB come terapia di prima linea un mese dopo. Dopo otto anni di MDB, il paziente è ancora vivo e non presenta né sintomi né progressione della malattia. Inoltre, il paziente 5371, che aveva una neoplasia gliale aplastica inoperabile, non ha ricevuto né intervento chirurgico né protocollo Stupp, ha iniziato la MDB come terapia di prima linea durante la progressione del tumore. Dopo sette anni, il paziente non ha sviluppato recrudescenza ed è libero dal cancro. Inoltre, il paziente 5251, con oligoastrocitoma inoperabile, non ha iniziato la terapia Stupp e non ha subito un intervento chirurgico. Otto anni dopo la MDB, il paziente è ancora vivo dopo otto anni senza progressione tumorale e conduce una vita normale.
DISCUSSIONE
Nei tumori cerebrali maligni e nel GBM, la prognosi rimane infausta nonostante la chirurgia, la chemio e la radioterapia, con una sopravvivenza mediana di 14-18 mesi dopo la diagnosi (Delgado-López & Corrales-García 2016). Nel nostro studio, il MDB ha migliorato l’aspettativa di vita e la qualità della vita ed evitato tossicità rilevanti (Di Bella et al. 2017; Di Bella et al. 2013a; Di Bella et al. 2013b; Di Bella 2005; Di Bella 2019; Di Bella 2010; Di Bella et al., 2018; Di Bella et al. 1979a; DiBella et al. 1979b; Di Bella 1997; Di Bella & Di Bella 2015; Di Bella & Gualano 2006; Di Bella & Di Bella 1998).
Durante la progressione della maggior parte dei tumori, con maggiore evidenza in quelli cerebrali, la percentuale di CSC rispetto ad altre componenti cellulari della popolazione neoplastica è elevata, ed è associata alla resistenza a chemio e radioterapia e alla rapida progressione della malattia. Per questo motivo abbiamo gradualmente aumentato il dosaggio delle molecole che influiscono negativamente sulle CSC e riprogrammano le CSC.
A differenza del protocollo di Stupp, la somministrazione metronomica in MDB di temozolomide (20 mg al mattino e alla sera) e idrossiurea (500 mg a pranzo) ha migliorato il controllo della proliferazione e l’invasività delle cellule tumorali. Inoltre, la somministrazione giornaliera di MLT (100mg) con la soluzione di retinoidi in vitamina E ha ridotto la mielotossicità di temozolomide e idrossiurea (Di Bella et al. 2013a; Di Bella et al. 2013b; Di Bella & Di Bella 2015; Di Bella & Gualano 2006).
Il MDB, in contrasto con un punto di vista oncologico classico, sposta l’asse terapeutico dai meccanismi citolitici, tossici e immunosoppressivi al contrasto della regolazione negativa dell’oncogenesi attraverso meccanismi diversi (Di Bella et al. 2018; Perry et al. 2008). Inoltre, i componenti differenzianti del MDB, come una soluzione di retinoidi in vitamina E, vitamine C, D e MLT, contrastano la capacità mutagena delle cellule tumorali, basata su un sistema di difesa e un programma di sopravvivenza che consente una riparazione efficiente e rapida dei danni al DNA indotta da chemio e radioterapia. Ad esempio, i procarioti, le prime forme di vita, sopravvivono ancora fino ai giorni nostri. Grazie a un sistema di difesa sviluppato durante l’evoluzione basato su un programma mutazionale, riparazione del DNA in caso di eventi avversi. Il programma di sopravvivenza dei procarioti definito lo stato di emergenza, “programma SOS”, è stato trasmesso alle cellule somatiche (Radman 1975). Inoltre, è stato dimostrato che il programma SOS è attivato nelle cellule tumorali e sono state identificate molte omologie nei geni delle cellule neoplastiche e batteriche (Israel 1996).
Le cellule tumorali in stress acuto implementano sistemi di riparazione del DNA ed esprimono o silenziano i geni a seconda delle loro esigenze, selezionando e conservando per ogni mutazione tutta una serie di vantaggi con velocità ed efficienza di gran lunga superiori alle cellule batteriche. Il sistema SOS consente alla popolazione neoplastica di diventare progressivamente insensibile a diversi farmaci oncoterapeutici attraverso la riparazione e la ricombinazione del DNA.
Il sistema SOS viene silenziato e inattivato in condizioni biologiche stabili, fermato trascrizionalmente da un repressore, la proteina LEX-A. Quando si verificano gravi danni nel DNA di una cellula somatica, il repressore trascrizionale LEX-A viene disattivato dal regolatore positivo REC-A. L’attivazione di SOS porta con sé una serie di mutazioni che riparano ma, allo stesso tempo, modificano il DNA, portando alla carcinogenesi. Le cellule mutanti avviano una progressione del programma SOS, in cui una continua selezione e conservazione delle mutazioni conferisce una serie di vantaggi, come confermato da (Lambert et al. 2011) e recentemente da (Russo et al. 2019).
In conclusione, gli obiettivi multistrategici della MDB sono l’inibizione dell’invasività proliferativa e dell’angiogenesi neoplastica e il silenziamento del sistema di sopravvivenza SOS attraverso componenti differenzianti, come la soluzione di retinoidi in vitamina E, MLT, vitamina C e D, ecc.
Inoltre, i componenti differenziativi della MDB mostrano attività trofiche, immunomodulatorie e antiossidanti, migliorano la vitalità e l’efficienza delle cellule normali e deprimono l’efficienza e la vitalità di quelle neoplastiche.
Il MDB sta ampliando la sua attività a numerose risposte vitali tipiche della biologia neoplastica. La MDB sposta l’asse terapeutico da un’attività meramente citotossica e citolitica che prevedeva un’eradicazione utopica e sfuggente per tutta la vita di tutte le cellule tumorali nel corpo a un ripristino dell’omeostasi immuno-neuro-endocrina. Una strategia più fisiologica ha pensato alla riconversione delle funzioni vitali che deviano nelle cellule tumorali, alla differenziazione delle cellule tumorali e alla riprogrammazione delle cellule staminali tumorali.
Tabelle 1. Principi attivi somministrati
Tabella 2. Età, diagnosi, trattamenti pregressi e inizio terapia MDB dei pazienti.
File pdf della traduzione di MDB006 Di Bella et al. (2021) “Uno studio osservazionale retrospettivo su casi di tumori cerebrali anaplastici trattati con il Metodo Di Bella: razionale ed efficacia – A retrospective observational study on cases of anaplastic brain tumors treated with the Di Bella Method: A rationale and effectiveness.” Neuroendocrinology letters 42(7):464–483.
 Loading...
Loading...